המומחה הרפואי של המאמר
פרסומים חדשים
היצרות רזנטוזה
סקירה אחרונה: 04.07.2025

כל תוכן iLive נבדק מבחינה רפואית או נבדק למעשה כדי להבטיח דיוק עובדתי רב ככל האפשר.
יש לנו קווים מנחים קפדניים המקור רק קישור לאתרים מדיה מכובד, מוסדות מחקר אקדמי, בכל עת אפשרי, עמיתים מבחינה רפואית מחקרים. שים לב שהמספרים בסוגריים ([1], [2] וכו ') הם קישורים הניתנים ללחיצה למחקרים אלה.
אם אתה סבור שתוכן כלשהו שלנו אינו מדויק, לא עדכני או מפוקפק אחרת, בחר אותו ולחץ על Ctrl + Enter.
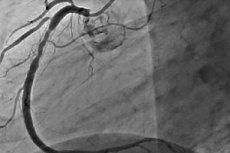
היצרות רזנטוזה לאחר אנגיופלסטיה כלילית טרנסלומינלית (TBCA)
לאחר היצרות ורידית (TBCA), שיעור ההיצרות הרסטנוזיס בששת החודשים הראשונים הוא 30-40%. המנגנון העיקרי להתפתחותה הוא עיצוב מחדש שלילי מקומי של כלי הדם, שהוא, במהותו, קריסה אלסטית של לומן העורקים, המורחבת על ידי הבלון במהלך ההליך. היווצרות פקקת מקומית וצמיחה ניאואינטימלית גם הם משחקים תפקיד יחסי. ישנם גורמי סיכון קליניים (סוכרת מסוג 2, תסמונת כלילית חריפה (ACS), היסטוריה של היצרות רסטנוזיס), אנגיוגרפיים (נגע LAD, קוטר כלי דם קטן, חסימה כרונית מלאה (CTO), נגע ארוך, שתלי מעקף ורידיים מנוונים) ופרוצדורליים (היצרות שיורית גדולה, עלייה קטנה בקוטר כלי הדם כתוצאה מניפוח הבלון) להיצרות רסטנוזיס לאחר TBCA. במקרה של היצרות רסטנוזיס, בדרך כלל מבוצעת התערבות חוזרת. הצלחת TBCA חוזרת באתר ההיצרות הרסטנוזיס דומה להליך הראשון. עם זאת, עם כל TBCA נוסף להיצרות רסטנוזיס, הסיכון להיצרות רסטנוזיס חוזרת עולה משמעותית. לאחר הניסיון השלישי, הוא מגיע ל-50-53%. בנוסף, עם כל היצרות מחדש של כלי דם כליליים (TBCA) חוזרת, היצרות מחדש המתפתחת בולטת יותר מהראשונה. גורמי סיכון להיצרות מחדש לאחר TBCA שנייה הם הופעתה המוקדמת של היצרות מחדש הראשונה (60-90 יום לאחר ההליך), נזק ל-LAD, נזק לכלי דם מרובים, סוכרת מסוג 2, יתר לחץ דם עורקי, תעוקת חזה לא יציבה וניפוחי בלונים מרובים במהלך ההליך הראשון. בהתחשב בתדירות הגבוהה של היצרות מחדש ובמנגנון התפתחותה, הוכנסו תומכנים כליליים לפרקטיקה הקלינית, אשר תיאורטית היו אמורים לבטל שיפוץ שלילי של כלי דם לאחר TBCA.
המחקרים הראשונים שהדגימו את יעילות התקנת תומכנים היו מחקרי STRESS ו-BENESTENT שפורסמו בשנת 1993. מחקר BENESTENT כלל 516 חולים עם היצרות חדשה שאובחנה בעורקים כליליים בקוטר גדול מ-3 מ"מ, אשר חולקו באקראי לשתי קבוצות: TBCA קונבנציונלי (n = 257) ו-TBCA עם הצבת תומכן (n = 259). לאחר 3 שנים, שיעור ההיצרות מחדש במהלך אנגיוגרפיה היה 32% בקבוצת ה-TBCA הקונבנציונלית ו-22% בקבוצת התקנת תומכן. הירידה היחסית בשיעור ההיצרות מחדש הייתה 31% (p < 0.01). בקבוצת התקנת התומכנים היה גם צורך נמוך יותר בר-וסקולריזציה חוזרת של שריר הלב (10 לעומת 20.6% בקבוצת ה-TBCA הקונבנציונלית; p < 0.01), דבר שהיה קשור לשיעור נמוך יותר של הישנות תעוקת חזה בקבוצת התקנת התומכן.
על פי מחקר STRESS (n = 407), שיעור ההיצרות הרסנוזיס היה נמוך יותר גם בקבוצת הסטנט (n ~ 205) מאשר בקבוצת ה-PTCA הקונבנציונלית (n = 202) - 31.6 לעומת 42.1% (p < 0.01). היתרון של שימוש בתומכנים על פני אנגיופלסטיה קונבנציונלית במקרה של היצרות רסנוזיס באתר ה-PTCA הודגם במחקר REST, שבו 383 חולים עם היצרות רסנוזיס חולקו באקראי לתומכן או אנגיופלסטיה כלילית טרנסלומינלית חוזרת מלעורית. היצרות רסנוזיס חוזרת שזוהתה אנגיוגרפית הייתה נמוכה ב-18% בקבוצת הסטנט (18 לעומת 5.32%; p < 0.03). רה-וסקולריזציה חוזרת של שריר הלב, שהיא אינדיקטור להיצרות רסנוזיס משמעותית קלינית, נדרשה גם היא בתדירות נמוכה משמעותית בקבוצת החולים שעברו סטנט (10 לעומת 27%; p < 0.001). לפיכך, תוצאות טובות יותר עם שימוש בתומכנים הוכחו לא רק בעורקים מקומיים, אלא גם במקרה של התערבות עבור רסטנוזיס שהתפתחה לאחר TBCA.
היצרות רזסטוזיס לאחר השתלת סטנט חשוף (BSI)
למרות שסטנטים כליליים ללא כיסוי הפחיתו את שכיחות הרסטנוזיס ב-30-40% בהשוואה ל-TBCA, 17-32% מהחולים מפתחים רסטנוזיס בתוך התומכן גם לאחר התקנת סטנט, מה שמחייב רה-וסקולריזציה חוזרת. מנגנון התפתחות היצרות בתוך התומכן (ISS) שונה מזה שב-TBCA. לאחר התקנת סטנט, התרומה העיקרית לרסטנוזיס היא היווצרות ניאואינטימה, ולא שיפוץ שלילי, כמו ב-TBCA, שכמעט נעדר באתר השתלת התומכן. ניאואינטימה נוצרת על ידי נדידה והתפשטות של תאי שריר חלק המייצרים מטריצה חוץ-תאית, אשר יחד עם התאים מרכיבה את הניאואינטימה. בנוסף, הישארות פקקת באתר התקנת התומכן חשובה גם היא בחולים עם סוכרת.
הסיווג העיקרי של היצרות בתוך התומכן (ISS) הוא הסיווג שהוצע על ידי מהראן, הכולל ארבעה סוגים בהתאם להיקף וחומרת הנגע: סוג I ISS - מקומי (פחות מ-10 מ"מ אורך), סוג II - מפושט (מעל 10 מ"מ אורך), סוג III - פרוליפרטיבי (מעל 10 מ"מ ומשתרע מעבר לתומכן) וסוג IV - ISS המוביל לחסימה. הסוג הראשון מחולק לתת-סוגים בהתאם למיקום בתומכן: 1a - על הכיפוף או בין סטנטים, 1b - שוליים, 1c - בתוך התומכן, 1d - רב-מוקדי.
גורמי סיכון להתפתחות של רסטינוזיס ורידי (VRS) הם התערבויות בשתלי מעקף ורידיים, חסימות כרוניות, נגעים באוסטיאליים, קוטר כלי דם קטן, נוכחות היצרות שיורית, התקנת סטנטים לצורך VRS, קוטר כלי דם קטן לאחר הפרוצדורה, נגע LAD, אורך סטנט ארוך, נוכחות סוכרת, השתלת מספר סטנטים בנגע אחד. ישנן אינדיקציות להשפעת גורמים גנטיים, בפרט פולימורפיזם של הגן גליקופרוטאין IIIa ומוטציות בגן מתילן-טטרהידרופולט רדוקטאז - הגן המקודד לאינטרלוקין-1. במקרה של התפתחות רסטינוזיס ורידי שולית, גורם הסיכון העיקרי הוא נגע טרשת עורקים בולט במקטע הסטנט.
היצרות רסטנוזיס מתרחשת בעיקר במהלך 6-8 החודשים הראשונים לאחר התערבות כלילית מלעורית. רוב החולים מפתחים תסמינים קליניים בערך באותו זמן. היצרות רסטנוזיס חוזרת מתבטאת בדרך כלל בתעוקת חזה חוזרת. תעוקת חזה לא יציבה מתרחשת בתדירות נמוכה יותר (11-41% מהמקרים). תעוקת חזה מתפתחת ב-1-6% מהחולים. לפיכך, הסיבה השכיחה ביותר לתעוקת חזה בתקופה של 1-6 חודשים לאחר התקנת סטנט היא התפתחות VRS, אשר, ככלל, דורשת רה-וסקולריזציה חוזרת ונשנית. ישנן מספר שיטות לטיפול ב-VRS. ניתן לבצע TBCA קונבנציונלי, מה שמוביל להתרחבות סטנט נוספת (תרומה של 56% לעלייה הסופית בקוטר כלי הדם) ודוחף את הניאואינטימה דרך תאי התומכן (תרומה של 44% לעלייה הסופית בקוטר). עם זאת, היצרות רסטנוזיס שיורית נצפית ברוב המקרים באתר ההתערבות (בממוצע 18%). בנוסף, לאחר TBCA, נדרשת רה-וסקולריזציה חוזרת ב-11% מהמקרים, בתדירות גבוהה יותר בחולים עם מחלת כלי דם רב-כלי דם, מקטע חילוף פליטי נמוך, במקרה של התערבויות בשתלי מעקף ורידיים או הופעה מוקדמת של VRS ראשון. הסיכון לפתח VRS חוזר לאחר TBCA תלוי גם בסוג הנגע ונע בין 10% במקרה של היצרות רזנטוזיס מקומית ל-80% במקרה של חסימה תוך-סטנט. השתלת LES באתר ה-VRS אינה מפחיתה את הסיכון להישנותו בהשוואה ל-TBCA בלבד.
השיטה השנייה לטיפול ב-VRS היא ברכיתרפיה, הכוללת החדרת מקור רדיואקטיבי לתוך לומן העורק הכלילי, מונעת את התפשטות תאי השריר החלק ובהתאם, מפחיתה את הסיכון להיצרות מחדש. עם זאת, העלות הגבוהה של הציוד, המורכבות הטכנית של ההליך והעלייה בשכיחות של טרומבוז מאוחר בתומכן (LT) כמעט והוציאה לחלוטין את השימוש בברכיתרפיה מהשימוש הקליני.
רגע מהפכני בטיפול ב-VRS היה הכנסת סטנטים משחררי תרופות. בהשוואה ל-LES בעורקים מקומיים, הם מפחיתים את הסיכון ל-VRS ב-70-80%. הנתונים הראשונים על יעילות ה-DES בחולים עם VRS שכבר מפותח התקבלו ברישום החולים TAXUS III, שבו, בעת שימוש ב-SPG1 בחולים כאלה, שכיחות הישנות VRS הייתה רק 16% לאחר 6 חודשים, נתון נמוך יותר מאשר במחקרים שהוזכרו קודם לכן עם TBCA. ברישום TRUE, שכלל חולים לאחר השתלת SES לצורך היצרות רזיסטנטית של LES, לאחר 9 חודשים, נדרשה רה-וסקולריזציה חוזרת בפחות מ-5% מהחולים, בעיקר עם סוכרת ו-ACS. מחקר TROPICAL השווה את שכיחות ההיצרות הרזיסטנטית החוזרת בחולים לאחר השתלת DES באתר ההיצרות הרזיסטנטית עם נתוני מחקרי GAMMA I ו-GAMMA II, בהם נעשה שימוש בברכיתרפיה כשיטת טיפול. לאחר 6 חודשים, שכיחות היצרות רזסטנוזיס חוזרת הייתה נמוכה משמעותית בקבוצת ה-SPS (9.7 לעומת 40.3%; p < 0.0001). חשוב לציין כי שכיחות טרומבוז התוספות של תומכן ואוטם שריר הלב הייתה נמוכה יותר גם בקבוצת ה-SPS (TS 0.6 לעומת 3.9%; p = 0.08; MI - 1.8 לעומת 9.4%; p = 0.004). היתרון של SPS על פני ברכיתרפיה אושר במחקר SISR האקראי, שבו 384 חולים עם VRS שפותח ב-NSC חולקו באקראי לקבוצות ברכיתרפיה או השתלת SPS. לאחר 9 חודשים, הצורך ברה-וסקולריזציה חוזרת היה גבוה יותר לאחר ברכיתרפיה (19.2%) מאשר בקבוצת השתלת SPS (8.5%), דבר שיקף הישנות תכופה יותר של רה-סנוזיס. לאחר 3 שנים, היתרון של SPS מבחינת הפחתת הצורך ברה-וסקולריזציה חוזרת עקב רה-סנוזיס חוזרת של תומכן נותר (19 לעומת 28.4%). לא נמצא הבדל משמעותי בשכיחות הטרומבוז בין הקבוצות.
הגורמים העיקריים להתפתחות של היצרות כליות חוזרת (VRS) בחולים עם LES במקרה של השתלת SPS הם קוטר כלי דם קטן (< 2.5 מ"מ), סוג מפושט של היצרות רזנטוזיס, ונוכחות של אי ספיקת כליות כרונית הדורשת המודיאליזה. במחקר האקראי TAXUS V ISR, SPS גם הדגים יעילות גבוהה בטיפול ב-VRS, והפחיתו את שיעור ההיצרות הרזנטוזיס החוזרת ב-54% בהשוואה לברכיתרפיה.
נערכו גם ניסויים אקראיים שהשוו את יעילות TBCA עבור השתלת VRS והשתלת DES. בניסוי RIBS-II האקראי, לאחר 9 חודשים, היצרות חוזרת הייתה פחות שכיחה ב-72% לאחר השתלת DES מאשר לאחר TBCA, מה שהפחית את הצורך ברה-וסקולריזציה חוזרת מ-30% ל-11%. ניסוי ISAR DESIRE השווה את יעילות TBCA עבור VRS עם השתלת SPP או SPS. לאחר 6 חודשים, התברר ששני סוגי ה-DES היו יעילים יותר במניעת רה-סנוזיס חוזרת מאשר TBCA (שיעור השכיחות היה 44.6% עם TBCA, 14.3% בקבוצת SPS ו-21.7% בקבוצת SPS), מה שהפחית את הצורך ברה-וסקולריזציה חוזרת. בהשוואה ישירה בין SPP ל-SPS, נמצא ש-SPS הפחית את הצורך ברה-וסקולריזציה חוזרת בצורה משמעותית יותר ביעילות רבה יותר מאשר SPP (8 לעומת 19%). לפיכך, השתלת DES מפחיתה את שכיחות אירועי LES VRS חוזרים בהשוואה הן ל-TBCA והן לברכיתרפיה, מה שמפחית את מספר ה-PCI החוזרים ולכן הופך את השתלתם להליך המועדף בחולים כאלה.
היצרות רזסטוזיס לאחר השתלת סטנט משחרר תרופה (DES)
למרות הירידה של 70-80% בשכיחות היצרות בתוך תומכן בעת שימוש ב-DES בהשוואה ל-LES, הם לא יכלו לשלול לחלוטין את התפתחותה של תוצאה יאטרוגנית זו של התקנת תומכן. שכיחותה הכוללת נותרה בממוצע פחות מ-10%. בנוסף לירידה הכמותית בשכיחות היצרות הרסטנוזיס, הם גם שינו באופן משמעותי את סוג היצרות הרסטנוזיס המתרחשת. לכן, לאחר השתלת DES, היצרות הרסטנוזיס היא בדרך כלל מוקדית. מבחינה קלינית, כמו במקרה של LES, היא מתבטאת לרוב כהישנות של תעוקת חזה יציבה (77%), בתדירות נמוכה יותר (8%) היא אסימפטומטית. ב-5% מהמקרים, היא מתבטאת כתעוקת חזה לא יציבה, וב-10%, התסמין הראשון שלה הוא אוטם שריר הלב שאינו גל Q. הגורמים העיקריים להתפתחות היצרות רסטנוזיס של DES הם סוכרת מסוג 2, קוטר כלי דם קטן והיקף הנגע. אין המלצות ברורות לטיפול בחולים כאלה. אפשרויות חלופיות הן השתלה חוזרת של DES (מאותו סוג או אחר), TBCA, או ברכיתרפיה. שיעור ההיצרות החוזרת הממוצע עם DES שני הוא 24%, והוא זהה בין אם מושתל אותו סוג של DES ובין אם שונה.


 [
[