המומחה הרפואי של המאמר
פרסומים חדשים
אבחון שלבי מהלך סרטן הערמונית
סקירה אחרונה: 04.07.2025

כל תוכן iLive נבדק מבחינה רפואית או נבדק למעשה כדי להבטיח דיוק עובדתי רב ככל האפשר.
יש לנו קווים מנחים קפדניים המקור רק קישור לאתרים מדיה מכובד, מוסדות מחקר אקדמי, בכל עת אפשרי, עמיתים מבחינה רפואית מחקרים. שים לב שהמספרים בסוגריים ([1], [2] וכו ') הם קישורים הניתנים ללחיצה למחקרים אלה.
אם אתה סבור שתוכן כלשהו שלנו אינו מדויק, לא עדכני או מפוקפק אחרת, בחר אותו ולחץ על Ctrl + Enter.
מבחינה קלינית, מבחינים בין סרטן מקומי (T1-2 , N0 , M0 ), סרטן מתקדם מקומית (T3-4 , N0-1 , M0 ) וסרטן כללי (T1-4 , N0-1 , M1 ).
חולים עם שלבים קליניים מקומיים ומתקדמים מקומית מסווגים לפי דרגת הסיכון (D'Amico A V. et al., 2003):
- נמוך: שלב T 1a-c; רמת PSA נמוכה מ-10 גרם/מ"ל: דירוג גליסון - 2-5; בביופסיה - נגע חד-צדדי פחות מ-50%:
- בינוני: שלב T 2a; רמת PSA נמוכה מ-10 ננוגרם/מ"ל; ציון גליסון - 3 + 4 = 7; בביופסיה - נגע דו-צדדי פחות מ-50%;
- T2b, T3a -b בשלב גבוה; רמת PSA - 10-20 ננוגרם/מ"ל; דירוג גליסון - יותר מ-4 + 3 - 7; בביופסיה - נזק של יותר מ-50%, פלישה פרינאורלית;
- גבוה מאוד: שלב T 4; רמת PSA מעל 20 ננוגרם/מ"ל; ציון גליסון מעל 8; ביופסיה מראה פלישה לימפו-וסקולרית.
לאחר שהאבחון הובהר וקביעת היקף התהליך (מקומי, מתקדם מקומי או כללי), הרופא והמטופל עומדים בפני בחירת שיטת טיפול. בחברה המודרנית, מיוחסת חשיבות רבה לאיכות חייהם של המטופלים לאחר תחילת הטיפול. איכות החיים ללא טיפול תואמת את מהלך המחלה הבסיסית ותלויה בהתקדמות התהליך האונקולוגי. שינויים באיכות החיים מתרחשים בעיקר לאחר תחילת הטיפול ושימוש באחת השיטות הטיפוליות או הכירורגיות. קביעת שלב ברור בתהליך מאפשרת לא רק לבחור את שיטת הטיפול האופטימלית, אלא גם לחזות את המשך מהלך המחלה.
קביעת רמת ה-PSA בשילוב עם התמונה הקלינית של סרטן הערמונית וההדרגה של הגידול לפי סולם גליסון מגדילה משמעותית את תכולת המידע של כל אחד מהאינדיקטורים המפורטים בקביעת השלב הפתולוגי של הסרטן. AV Partin ואחרים (1997) הציעו טבלאות פרוגנוסטיות המאפשרות לחזות את התפשטות הגידול בהמשך, בחירת שיטת הטיפול, מידת הרדיקליות והפרוגנוזה של יעילות הטיפול.
כדי להעריך את התפשטות הגידול, השיטות הנפוצות ביותר הן DRE, TRUS, קביעת רמת PSA וסקינטיגרפיה של העצם. במידת הצורך, נקבעים טומוגרפיה ממוחשבת (CT) או דימות תהודה מגנטית (MRI) וצילום רנטגן של החזה.
כל אחת משיטות ההדמיה נועדה לקבוע את השלב ולהעריך את יעילות הטיפול. לאחר אימות האבחנה, על האורולוג לברר את נפח הגידול הראשוני, גבולותיו, פוטנציאל פולשני או גרורתי של הגידול. לכל האינדיקטורים הללו חשיבות רבה לפרוגנוזה של המחלה ולבחירת שיטת הטיפול.
גידול ראשוני (T)
ראשית, יש לקבוע האם הגידול מוגבל לבלוטת הערמונית (T 1-2 ) או משתרע מעבר לקפסולה (T 3-4 ). בדיקה דיגיטלית לעיתים קרובות אינה מאפשרת להעריך את התפשטות הגידול. על פי נתונים מסוימים, תוצאות ה-DRE תואמות את אלו של בדיקה היסטולוגית בפחות מ-50% מהחולים. עם זאת, בדיקה מפורטת יותר נדרשת רק כאשר מחליטים על טיפול רדיקלי.
רמת ה-PSA עשויה לשקף את היקף הגידול, אך אינה מאפשרת קביעה מדויקת של השלב המורפולוגי. השילוב של רמת ה-PSA, מדד גליסון ונתוני המישוש מאפשר חיזוי טוב יותר של השלב המורפולוגי מכל אחד מהפרמטרים הללו בנפרד. ערכו של ה-PSA החופשי שנוי במחלוקת: במחקר אחד, קביעת תכולת ה-PSA החופשי סייעה להבהיר את השלב בגידולים מקומיים, אך מחקרים אחרים לא אישרו זאת. רק מחקרים מעמיקים יסייעו בפתרון בעיה זו.
אולטרסאונד טרנסרקטלי משמש לרוב לבדיקת מצב בלוטת הערמונית. שיטה זו יכולה לזהות רק 60% מהגידולים ולא תמיד מראה פלישת קפסולה. כמעט 60% מהחולים עם שלב T3 . אולטרסאונד מצביע על תהליך פחות שכיח. סימני אולטרסאונד לפלישה לקפסולה הם בליטה, חוסר אחידות וקרע של קווי המתאר של הבלוטה. פלישת תאי גידול לתוך שלפוחיות הזרע היא סימן פרוגנוסטי גרוע, אך מידע עליו חשוב ביותר לבחירת שיטת טיפול. בעת ביצוע TRUS, יש לשים לב לאקו-מבנה של שלפוחיות הזרע (היפר-אקוגניות), לאסימטריה שלהן, לעיוות ובהתפשטות שלהן. כמו כן, נזק לשלפוחיות הזרע מסומן על ידי אובדן עגלגלות ודחיסה בבסיס הבלוטה. סימנים אלה הם סובייקטיביים למדי, ולכן לא ראוי להסתמך לחלוטין על נתוני אולטרסאונד. פלישת שלפוחיות הזרע מצביעה על סיכון גבוה להישנות מקומית וגרורות, וביופסיה שלהן מסומנת לבירור (לפני ניתוח). אין להתחיל את הבדיקה בהליך זה, אך אם הסיכון לפלישה גבוה ובחירת הטיפול תלויה בתוצאת הביופסיה, אזי יישומה מוצדק. תוצאה שלילית אינה שוללת פלישה מיקרוסקופית. ככלל, ביופסיה של שלפוחיות הזרע מתבצעת בשלב הקליני T 2b ומעלה ותכולת ה-PSA עולה על 10 ng/ml. התוצאה נחשבת חיובית אם לפחות ביופסיה אחת מבסיס בלוטת הערמונית מכילה תאי גידול. לא רק מחקרים נוספים, אלא גם ניתוח יסודי של תוצאות הביופסיה הראשונית מאפשרים להגביר את דיוק הקביעה הקלינית של השלב (מספר והיקף מוקדי הגידול, פלישת הקפסולה משחקים תפקיד). גם מידת ההתמיינות חשובה: עם מדד גליסון נמוך מ-6, הגידול ממוקם ב-70% מהמקרים.
זרימת הדם בבלוטת הערמונית עם סרטן גבוהה יותר מאשר בבלוטה רגילה או עם היפרפלזיה שלה. לאחר הסירוס, עוצמת זרימת הדם בבלוטה מצטמצמת. פיתוח מפות אקו-דופלרוגרפיה לאבחון וניטור סרטן הערמונית מבטיח, אך נכון לעכשיו אין נתונים אמינים על השימוש באקו-דופלרוגרפיה בקביעת שלב התהליך המקומי. ניתן להשתמש בשיטה זו כדי להשיג חומר נוסף במהלך ביופסיה ממוקדת ממוקדי וסקולריזציה פתולוגית.
תוצאות הדמיית סרטן הערמונית תלויות ישירות בציוד הטכני של המרפאה ובניסיון המומחה. זו הסיבה שכל שיטות ההדמיה המודרניות ממלאות תפקיד לא מכריע אלא מבהיר, ובחירת שיטת הטיפול מבוססת על שילוב של נתוני בדיקה קלינית ומחקרים אינסטרומנטליים.
ל-MRI יש את היכולות הטובות ביותר להמחשת מבנה בלוטת הערמונית. הסטנדרט המודרני לבדיקת איברי האגן בשיטת MRI הוא שימוש בחיישן אנדורקטלי, המאפשר קבלת תמונה ברזולוציה מרחבית גבוהה ביותר האפשרית של 0.5-1 מ"מ. דחיפה של אוויר לחיישן האנדורקטלי מספקת הדמיה ברורה של קפסולת הערמונית, זוויות רקטופרוסטטיות ופאשיה רקטופרוסטטית של דנונווילייה. השימוש בחיישן אנדורקטלי ב-MRI אינו מגביל את ההדמיה של בלוטות לימפה אזוריות (עד לרמת הביפורקציה של אבי העורקים הבטני). סרטן הערמונית מאופיין בעוצמת אות נמוכה בתמונות משוקללות T על רקע אות בעוצמה גבוהה מאזור פריפריאלי ללא שינוי של הבלוטה. צורה לא סדירה, התפשטות מפושטת עם אפקט מסה, קווי מתאר מטושטשים ולא אחידים הם מאפיינים מורפולוגיים של מוקדים בעלי עוצמת אות נמוכה באזור הפריפריאלי של בלוטת הערמונית, דבר המצביע על אופי ניאופלסטי של הנגע. בעת ביצוע ניגודיות דינמית, מוקדי סרטן צוברים במהירות את חומר הניגוד בשלב העורקי ומסירים אותו במהירות, דבר המשקף את מידת האנגיוגנזה ובהתאם את מידת הממאירות של הגידול. עוצמת אות נמוכה אופיינית גם למוקדי דימומים לאחר ביופסיה, דלקת הערמונית, היפרפלזיה שפירה סטרומלית של האזור הנייטרלי של הבלוטה, שינויים סיביים-צלקתיים, היפרפלזיה פיברומוסקולרית, והשלכות של טיפול הורמונלי או טיפול בקרינה. MRI ללא ניגודיות דינמית אינו מאפשר הבחנה אמינה של רוב השינויים והמחלות המפורטות.
כפי שצוין לעיל, אחת המשימות העיקריות של כל שיטת הדמיה לסרטן הערמונית היא לקבוע את נפח הנגע בבלוטה ואת התפשטות הגידול מעבר לקפסולה. קביעת נפח הגידול חשובה לפרוגנוזה. נפח גידול של פחות מ-4 סמ"ק מצביע על גרורות מרוחקות, ו-12 סמ"ק מצביעים על סבירות גבוהה ביותר לגרורות. על פי מחקרים, דיוק ה-MRI בזיהוי מוקדים של נגעים ניאופלסטיים של בלוטת הערמונית נע בין 50 ל-90%. רגישות ה-MRI בקביעת לוקליזציה של סרטן הערמונית היא כ-70-80%, בעוד שלא ניתן לזהות מוקדים מיקרוסקופיים של סרטן (foci) באמצעות MRI.
היתרון החשוב ביותר של MRI אנדורקטלי הוא היכולת לאתר נגעים ניאופלסטיים באזורים שאינם נגישים לשיטות אבחון אחרות ולהבהיר את אופי וכיוון צמיחת הגידול. לדוגמה, MRI מאפשר לזהות נגעים ניאופלסטיים בחלקים הקדמיים של האזור ההיקפי של בלוטת הערמונית, שאינם נגישים באמצעות ביופסיה טרנסרקטלית. באופן כללי, MRI משלים באופן משמעותי את נתוני DRE ו- TRUS על לוקליזציה של הגידול.
MRI אנדורקטלי מאפשר הדמיה של קפסולת הבלוטה, צרורות עצבים-וסקולריים, שלפוחיות הזרע, קודקוד הבלוטה, מקלעת ורידית סביב הערמונית וקביעת שכיחות מקומית של גידול הבלוטה. יש להדגיש כי חדירת קפסולה נחשבת לסימן מיקרוסקופי, ואפילו מכשירי MRI מודרניים (סליל אנדורקטלי) אינם מסוגלים לספק מידע כזה. ניתן לקבל נתונים רק על גדילה מעבר לקפסולת הבלוטה.
קריטריונים לאבחון הרחבה חוץ-קפסולרית באמצעות MRI:
- נוכחות של גידול חוץ-קפסולי;
- קו מתאר לא אחיד של הבלוטה (עיוות, זוויתיות);
- אסימטריה של צרורות נוירווסקולריים;
- מחיקת הזוויות הרקטופרוסטטיות;
- מגע רחב של הגידול עם הקפסולה.
הספציפיות הגבוהה ביותר (עד 95-98%) והדיוק הגבוהים ביותר של תוצאות MRI מושגים בבדיקת חולים עם סיכון בינוני או גבוה לפלישה חוץ-קפסולרית. ההערכה היא שפלישה חוץ-קפסולרית (על פי נתוני MRI) מעידה על חוסר הולם של טיפול כירורגי ועל פרוגנוזה שלילית למחלה. טיפול הורמונלי או טיפול בקרינה אינו משפיע על הדיוק של גילוי התפשטות חוץ-קפסולרית של גידול הערמונית. הקושי העיקרי בגילוי מוקדי סרטן והתפשטות חוץ-קפסולרית של הגידול הוא השונות הגבוהה של פרשנות טומוגרמה על ידי מומחים שונים. המשימה העיקרית של מומחה באבחון קרינה היא להשיג ספציפיות אבחנתית גבוהה (גם על חשבון רגישות) על מנת לא למנוע מחולים ניתנים לניתוח את הסיכוי לטיפול רדיקלי.
הדמיון בצפיפות של רקמת ערמונית סרטנית, היפרפלסטית ותקינה ב-CT הופך שיטה זו ללא שימושית במיוחד להערכת ההתפשטות המקומית של הגידול. חדירה לתוך שלפוחיות הזרע חשובה יותר מחדירה לתוך הקפסולות, אך גם במקרה זה CT מספק מידע רק במקרים מתקדמים. עם זאת, שיטה זו משמשת באופן פעיל לסימון אזור הפגיעה לפני טיפול בקרינה.
ההתפתחות האיטית של אבחון קרינה בארצנו הובילה לאבחון מאוחר של סרטן הערמונית, וכתוצאה מכך לשכיחות לא מספקת של שיטות רדיקליות לטיפול בסרטן הערמונית (לדוגמה, כריתת ערמונית), זמינות נמוכה של טומוגרפים מודרניים והיעדר תוכניות הכשרה מתאימות למומחים באבחון קרינה ולאורולוגים. למרות העובדה ש-CT ו-MRI נפוצים כיום, רמת הציוד במרפאות וההכשרה של מומחים באבחון קרינה אינה מספיקה כדי שהמידע המתקבל יהיה מכריע בבחירת שיטת טיפול לחולים בסרטן הערמונית.
בלוטות לימפה אזוריות (N)
יש לבדוק בלוטות לימפה אזוריות רק כאשר הדבר משפיע ישירות על אסטרטגיית הטיפול (בדרך כלל בעת תכנון טיפול רדיקלי). רמות PSA גבוהות, גידולי T2c -T3a, התמיינות לקויה ופלישה פרינאורלית קשורים לסיכון גבוה לגרורות בבלוטות הלימפה. הערכת מצב בלוטות הלימפה על סמך רמות PSA נחשבת כבלתי מספקת.
רק לימפדנקטומיה (פתוחה או לפרוסקופית) מספקת את המידע הדרוש. מחקרים אחרונים של לימפדנקטומיה מורחבת הראו שסרטן הערמונית לא תמיד משפיע על בלוטות הלימפה הסותמות. בגידולים אסימפטומטיים ורמות PSA נמוכות מ-20 ק"ג/מ"ל, CT מאשר בלוטות לימפה מוגדלות רק ב-1% מהמקרים. השימוש ב-MRI או CT מוצדק במקרים של סיכון גבוה לגרורות, מכיוון שהספציפיות של שיטות אלו מגיעה ל-93-96%. עם זאת, אפילו תוצאה חיובית בעת השימוש בהן יכולה להיות שגויה, ורק ניקוב של בלוטת לימפה חשודה מאפשר לסרב ללימפדנקטומיה. על פי ניתוח רטרוספקטיבי, גודל בלוטת הלימפה לא תמיד מעיד על נוכחות גרורות בה; אסימטריה של בלוטות הלימפה הפגועות נחשבת לסימן אינפורמטיבי יותר. נכון לעכשיו, רק 2-3% מהחולים שעברו כריתה רדיקלית של הערמונית לסרטן ערמונית מקומי מאובחנים עם גרורות לבלוטות הלימפה על סמך בדיקה היסטולוגית לאחר הניתוח.
טומוגרפיה של פליטת פוזיטרונים (PET) וסינטיגרפיה עם נוגדנים מסומנים מומלצות כשיטות לאיתור גרורות לבלוטות הלימפה, אך השימוש בהן עדיין מוגבל עקב רגישות לא מספקת.
ניתן להשתמש בנומוגרמות של פרטין (2001) כדי להעריך את הסיכון למעורבות בלוטות לימפה אזוריות. נומוגרמות הן אלגוריתמים מתמטיים המשמשים עבור מטופל ספציפי או קבוצת מטופלים. טבלאות אלו מאפשרות לקבוע את ההסתברות להתפשטות הגידול המקומית (לקפסולה, שלפוחיות הזרע) ומעורבות בלוטות הלימפה בהתבסס על השלב הקליני, רמת ה-PSA ומדד גליסון. בפרט, הן מאפשרות לזהות קבוצת מטופלים עם הסתברות נמוכה (פחות מ-10%) לגרורות בבלוטות הלימפה (עם רמת PSA מעל 20 ng/md, שלב T 1-2a ומדד גליסון 2-6); בקבוצה זו, ייתכן שלא ניתן לציין את מצב בלוטות הלימפה לפני טיפול רדיקלי. ניתן להעריך את הסיכון לגרורות בבלוטות הלימפה גם על ידי גילוי אזורי גידול עם אנפלזיה בולטת (4-5 נקודות): אם אזורים כאלה נמצאים בארבע ביופסיות או יותר או שהם שולטים בביופסיה אחת לפחות, הסיכון מגיע ל-20-45%. במטופלים אחרים הוא אינו עולה על 2.5%. אין צורך בבדיקה נוספת במקרים כאלה.
גרורות מרוחקות (M)
ב-85% מהחולים המתים מסרטן הערמונית, מתגלים נגעים בשלד הצירי. גרורות בעצמות מתרחשות עקב חדירת תאי סרטן למח העצם עם זרם הדם, מה שמוביל לגדילת גידול וליזיס של מבני העצם. שכיחותן של גרורות בעצמות משפיעה על הפרוגנוזה, וגילוי מוקדם שלהן מזהיר את הרופא מפני סיבוכים אפשריים. ב-70% מהמקרים, גרורות משולבות עם עלייה בפעילות האיזואנזים של פוספטאז אלקליין (ALP) בעצם. קביעת פעילות ה-ALP ורמת ה-PSA ברוב המכריע של המקרים מאפשרת לנו לזהות גרורות בעצמות. על פי ניתוח רב משתנים, אינדיקטורים אלה מושפעים רק ממספר הגרורות בעצמות. חשוב שפעילות האיזואנזים ALP בעצם תשקף את מידת הנזק לעצם בצורה מדויקת יותר מרמת ה-PSA.
סינטיגרפיה נחשבת לשיטה הרגישה ביותר לגילוי גרורות בעצמות (היא עדיפה על רדיוגרפיה וקביעת פעילות פוספטאז אלקלי וחומצי). טכנציום דיפוספונטים משמשים טוב יותר כתרופה רדיואקטיבית, מכיוון שהצטברותם בעצמות פעילה הרבה יותר מאשר ברקמות רכות. נמצא מתאם בין הערכה חצי-כמותית של נזק לעצמות להישרדות. גילוי גרורות מרוחקות אפשרי בכל איבר. הן מופיעות לרוב בבלוטות לימפה לא אזוריות, בריאות, כבד, מוח ועור. במקרה של תלונות ותסמינים תואמים, משתמשים ברדיוגרפיית חזה, אולטרסאונד, CT ו-MRI כדי לגלות אותן. הטקטיקות לחשד לגרורות בעצמות מוצגות בתרשים.
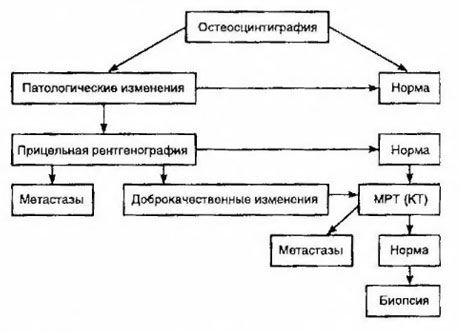
מדד המעבדה האמין ביותר המסייע בקביעת מידת הגרורות הוא רמת ה-PSA. הוכח כי עלייתה מעל 100 ננוגרם/מ"ל היא הפרמטר היחיד שמצביע באופן אמין על גרורות מרוחקות. קביעת רמת ה-PSA מפחיתה את מספר החולים הזקוקים לבדיקת סינטיגרפיה בעצמות. ההסתברות לגילוי גרורות בעצמות עם ירידה ברמת ה-PSA נמוכה מאוד. בהיעדר תלונות ותכולת PSA התחלתית נמוכה מ-20 ננוגרם/מ"ל, ניתן להימנע מגילוי גידולים בעלי התמיינות גבוהה ובינונית, ניתן להימנע מבדיקת סינטיגרפיה. יחד עם זאת, במקרה של גידולים בעלי התמיינות נמוכה ופלישה לקפסולה, מומלץ לבצע סינטיגרפיה (ללא קשר לרמת ה-PSA).


 [
[