המומחה הרפואי של המאמר
פרסומים חדשים
וירוס הכשל החיסוני האנושי (HIV)
סקירה אחרונה: 04.07.2025

כל תוכן iLive נבדק מבחינה רפואית או נבדק למעשה כדי להבטיח דיוק עובדתי רב ככל האפשר.
יש לנו קווים מנחים קפדניים המקור רק קישור לאתרים מדיה מכובד, מוסדות מחקר אקדמי, בכל עת אפשרי, עמיתים מבחינה רפואית מחקרים. שים לב שהמספרים בסוגריים ([1], [2] וכו ') הם קישורים הניתנים ללחיצה למחקרים אלה.
אם אתה סבור שתוכן כלשהו שלנו אינו מדויק, לא עדכני או מפוקפק אחרת, בחר אותו ולחץ על Ctrl + Enter.
תסמונת הכשל החיסוני הנרכש זוהתה כמחלה ספציפית בשנת 1981 בארצות הברית, כאשר מספר צעירים פיתחו מחלות קשות הנגרמות על ידי מיקרואורגניזמים שאינם פתוגניים או פתוגניים חלשים עבור אנשים בריאים. מחקר על מצבם החיסוני של חולים גילה ירידה חדה במספר הלימפוציטים באופן כללי ובנוגדני T עוזרים בפרט. מצב זה נקרא איידס (תסמונת הכשל החיסוני הנרכש). שיטת ההדבקה (מגע מיני, דרך דם ותכשיריו) הצביעה על אופייה הזיהומי של המחלה.
הגורם לאיידס התגלה בשנת 1983 באופן עצמאי על ידי הצרפתי ל. מונטנייה, שכינה אותו נגיף LAV Lymphoadenopathy Associated Virus, מכיוון שמצא אותו בחולה עם לימפדנופתיה; והאמריקאי ר. גאלו, שכינה את הנגיף HTLV-III (Human T-lymphotropic Virus III): הוא גילה בעבר נגיפים לימפוטרופיים I ו-II.
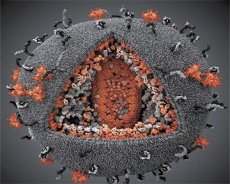
השוואה בין תכונותיהם של נגיפי LAV ו-HTLV-III הראתה את זהותם, ולכן כדי למנוע בלבול, הנגיף נקרא HIV (וירוס הכשל החיסוני האנושי, או HIV) בשנת 1986. ל-HIV צורה כדורית, בקוטר של 110 ננומטר. מעטפת הנגיף בצורת פוליהדרון, המורכבת מ-12 מחומשים ו-20 משושים. במרכז ובפינות של כל משושה נמצאת מולקולה של חלבון גליקוזילי gpl20 (המספר 120 מציין את המשקל המולקולרי של החלבון בקילודלטון). סך של 72 מולקולות gpl20 ממוקמות על פני השטח של הוויריון בצורת קוצים ייחודיים, שכל אחד מהם קשור לחלבון התוך-ממברנלי gp41. חלבונים אלה, יחד עם שכבת השומנים הכפולה, יוצרים את הסופר-קפסיד (ממברנה) של הוויריון.
חלבוני gpl20 ו-gp41 נוצרים על ידי חיתוך חלבון ה-Env המבשר על ידי פרוטאז תאי. חלבון gp41 יוצר את "הגבעול" על ידי קשירה עם הדומיין הציטופלזמי שלו לחלבון המטריצה p17MA הממוקם ישירות מתחת למעטפת. מולקולות p17 מקיימות אינטראקציה במהלך התבגרות הוויריון ויוצרות איקוסהדרון שמתחת למעטפת.
בחלק המרכזי של הוויריון, חלבון p24 יוצר קפסיד בצורת חרוט. החלק הצר של הקפסיד מחובר לקרום הוויריון בהשתתפות חלבון ה-rb. בתוך הקפסיד, ישנן שתי מולקולות זהות של RNA גנומי ויראלי. הן מחוברות בקצוות ה-5' שלהן לחלבון הנוקלאוקפסיד p7NC. חלבון זה מעניין מכיוון שיש לו שתי שיירי חומצות אמינו (מוטיבים) עשירים בציסטאין והיסטידין ומכילים אטום Zn - הם נקראים "אצבעות אבץ" מכיוון שהן לוכדות מולקולות של RNA גנומי להכללה בויריונים הנוצרים. הקפסיד מכיל גם שלושה אנזימים. רברטאז (RT), או קומפלקס pol, כולל רוורס טרנסקריפטאז, RNase H ו-DNA פולימראז תלוי DNA. רברטאז קיים כהטרודימר p66/p51. פרוטאז (PR) - p10, יוזם ומיישם את תהליך התבגרות הוויריון. אינטגראז (IN) - p31, או אנדונוקלאז, מבטיח את הכללת ה-DNA הפרו-ויראלי בגנום התא המארח. הקפסיד מכיל גם מולקולה של RNA פריימר (tRNAl"3).
גנום ה-RNA בתא מומר לגנום DNA (פרו-וירוס DNA) בעזרת טרנסקריפטאז הפוך, המורכב מ-9283 זוגות נוקלאוטידים. הוא מוגבל משמאל ומימין על ידי מה שנקרא חזרות טרמינליות ארוכות, או LTRs: S'-LTR משמאל ו-3'-LTR מימין. LTRs מכילים 638 זוגות נוקלאוטידים כל אחד.
גנום ה-HIV מורכב מ-9 גנים, שחלקם חופפים בקצוות (בעלי מספר מסגרות קריאה) ובעלי מבנה אקסוניטרוני. הם שולטים על הסינתזה של 9 חלבונים מבניים ו-6 חלבונים רגולטוריים.
חשיבותם של LTRs עבור הגנום הוויראלי היא שהם מכילים את האלמנטים הרגולטוריים הבאים השולטים בתפקודו:
- אות שעתוק (אזור מקדם);
- אות חיבור של פולי-A;
- אות מכסה;
- אות אינטגרציה;
- אות בקרה חיובי (TAR עבור חלבון TAT);
- אלמנט רגולטורי שלילי (NRE עבור חלבון NEF);
- אתר להצמדת RNA של פריימר (tRNA™3) לסינתזת DNA של גדיל מינוס בקצה 3'; אות בקצה 5' של ה-LTR המשמש כפריימר לסינתזת DNA של גדיל פלוס.
בנוסף, LTR מכיל אלמנטים המעורבים בוויסות שחבור mRNA, אריזה של מולקולות vRNA לתוך הקפסיד (אלמנט Psi). לבסוף, במהלך שעתוק הגנום, נוצרים שני אותות ב-mRNA ארוך עבור חלבון REV, אשר מעבירים את סינתזת החלבון: CAR - עבור חלבונים רגולטוריים ו-CRS - עבור חלבונים מבניים. אם חלבון REV נקשר ל-CAR, מסונתזים חלבונים מבניים; אם הוא נעדר, מסונתזים רק חלבונים רגולטוריים.
הגנים הרגולטוריים הבאים והחלבונים שלהם ממלאים תפקיד חשוב במיוחד בוויסות תפקוד גנום הנגיף:
- חלבון TAT, אשר מבצע בקרה חיובית של שכפול נגיפי ופועל דרך אזור הרגולציה של TAR;
- חלבוני NEV ו-VPU, אשר מפעילים בקרה שלילית על שכפול דרך אזור NRE;
- חלבון REV, המבצע בקרה חיובית-שלילית. חלבון REV שולט על עבודת הגנים gag, pol ו-env ומבצע ויסות שלילי של שחבור.
לפיכך, שכפול HIV נמצא תחת שליטה משולשת - חיובי, שלילי וחיובי-שלילי.
חלבון ה-VIF קובע את יכולת ההדבקה של הנגיף המסונתז החדש. הוא קשור לחלבון הקפסיד p24 ונמצא בויריון בכמות של 60 מולקולות. חלבון ה-NEF מיוצג בויריון על ידי מספר קטן של מולקולות (5-10), שקשורות אולי למעטפת.
חלבון ה-VPR מעכב את מחזור התא בשלב G2, משתתף בהובלת קומפלקסים טרום-אינטגרצייתיים לתוך גרעין התא, מפעיל כמה גנים ויראליים ותאיים, ומגביר את יעילות שכפול הנגיף במונוציטים ובמקרופאגים. מיקום חלבוני ה-VPR, TAT, REV ו-VPU בויריון לא נקבע.
בנוסף לחלבונים שלה, קרום הוויריון עשוי להכיל כמה חלבונים של התא המארח. חלבוני VPU ו-VPR משתתפים בוויסות הרבייה הנגיפית.
וריאנטים אנטיגניים של נגיף הכשל החיסוני האנושי (HIV)
נגיף הכשל החיסוני האנושי (HIV) הוא מגוון מאוד. אפילו מגופו של חולה אחד, ניתן לבודד זני נגיף הנבדלים באופן משמעותי בתכונות האנטיגניות שלהם. שונות כזו מתאפשרת על ידי הרס אינטנסיבי של תאי CD4+ ותגובת נוגדנים חזקה לזיהום HIV. צורה חדשה של HIV, HIV-2, הקרובה ביולוגית ל-HIV-1 אך שונה ממנו מבחינה אימונולוגית, בודדה מחולים ממערב אפריקה. ההומולוגיה של המבנה הראשוני של הגנומים של נגיפים אלה היא 42%. הפרו-וירוס DNA HIV-2 מכיל 9671 בסיסים, ו-LTR שלו - 854 בסיסים. HIV-2 בודד לאחר מכן באזורים אחרים בעולם. אין חסינות צולבת בין HIV-1 ל-HIV-2. ידועות שתי צורות עיקריות של HIV-1: O (חריג) ו-M (מייג'ור), האחרון מחולק ל-10 תת-סוגים (AJ). שמונה תת-סוגים (AH) נפוצים ברוסיה.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
מנגנון האינטראקציה של HIV עם התא
לאחר שחדר לגוף, הנגיף תוקף תחילה תאים המכילים את קולטן CD4 הספציפי לו. קולטן זה קיים בכמויות גדולות בקולטן T עוזר, בכמויות קטנות יותר במקרופאגים ובמונוציטים, וקולטן T עוזר רגישים במיוחד לנגיף.
נגיף הכשל החיסוני האנושי (HIV) מזהה קולטני CD4 באמצעות חלבון gpl20 שלו. תהליך האינטראקציה של HIV עם התא מתרחש לפי הסכימה הבאה: ספיחה בתיווך קולטן -> גומה מצופה -> שלפוחית מצופה -> ליזוזום. בו, קרום הוויריון מתמזג עם קרום הליזוזום, והנוקלאוקפסיד, ששוחרר מהסופרקפסיד, נכנס לציטופלזמה; בדרך לגרעין, הוא נהרס, ו-RNA גנומי ורכיבי הליבה הנלווים אליו משתחררים. לאחר מכן, רוורס טרנסקריפטאז מסנתז את גדיל המינוס של ה-DNA על ה-RNA של הוויריון, לאחר מכן RNase H הורס את ה-RNA של הוויריון, ו-DNA פולימראז ויראלי מסנתז את גדיל הפלוס של ה-DNA. 5'-LTR ו-3'-LTR נוצרים בקצוות פרו-וירוס ה-DNA. פרו-וירוס ה-DNA יכול להישאר בגרעין למשך זמן מה בצורה לא פעילה, אך במוקדם או במאוחר הוא משולב בכרומוזום של תא המטרה בעזרת האינטגראז שלו. בתוכו, הפרו-וירוס נשאר לא פעיל עד שלימפוציט T נתון מופעל על ידי אנטיגנים מיקרוביאליים או תאים אימונוקומפטנטיים אחרים. הפעלת שעתוק ה-DNA התאי מווסתת על ידי גורם גרעיני מיוחד (NF-kB). זהו חלבון קושר DNA והוא מיוצר בכמויות גדולות במהלך ההפעלה וההתרבות של לימפוציטים T ומונוציטים. חלבון זה נקשר לרצפים מסוימים של DNA תאי ולרצפי LTR דומים של פרו-וירוס ה-DNA ומשרה שעתוק של DNA תאי ופרו-וירוס DNA כאחד. על ידי גרימת שעתוק של פרו-וירוס ה-DNA, הוא מבצע את המעבר של הווירוס ממצב לא פעיל למצב פעיל, ובהתאם, מזיהום מתמשך לזיהום פרודוקטיבי. הפרו-וירוס יכול להישאר במצב לא פעיל במשך זמן רב מאוד. הפעלת הווירוס היא רגע קריטי באינטראקציה שלו עם התא.
מרגע חדירת הנגיף לתא, מתחילה תקופת ההדבקה ב-HIV - מצב נשא הנגיף, שיכול להימשך 10 שנים או יותר; ומרגע הפעלת הנגיף, מתחילה המחלה - איידס. בעזרת הגנים הרגולטוריים שלו ותוצריהם, הנגיף מתחיל להתרבות באופן פעיל. חלבון TAT יכול להגביר את קצב רביית הנגיף פי 1000. שעתוק ויראלי הוא מורכב. הוא כולל היווצרות של mRNA באורך מלא ותת-גנומי, שחבור mRNA, ולאחר מכן מתרחשת סינתזה של חלבונים מבניים ורגולטוריים.
סינתזה של חלבונים מבניים מתרחשת באופן הבא. ראשית, מסונתז הפוליפרוטאין Pr55Gag (חלבון בעל משקל מולקולרי של 55 kDa). הוא מכיל 4 דומיינים עיקריים: מטריצה (MA), קפסיד (CA), נוקלאוקפסיד (NC) ותחום rb, שממנו, כתוצאה מחיתוך Pr55Gag על ידי פרוטאז ויראלי (הוא נחתך מעצמו מחלבון מבשר אחר, Gag-Pol), נוצרים החלבונים המבניים p17, p24, p7 ו-rb, בהתאמה. היווצרות הפוליפרוטאין Pr55Gag היא התנאי העיקרי להיווצרות חלקיקים נגיפיים. חלבון זה הוא שקובע את תוכנית המורפוגנזה של הוויריון. הוא כולל ברצף את שלבי ההובלה של פוליפרוטאין Gag לממברנת הפלזמה, אינטראקציה עמו ואינטראקציות חלבון-חלבון במהלך היווצרות החלקיק הנגיף והניצתו. Pr55Gag מסונתז על פוליריבוזומים חופשיים; מולקולות חלבון מועברות לממברנה, שם הן מעוגנות על ידי האזורים ההידרופוביים שלהן. תחום CA ממלא את התפקיד העיקרי ביצירת הקונפורמציה הטבעית של חלבון Gag. תחום NC מבטיח את הכללתן (בעזרת "אצבעות האבץ" שלו) של 2 מולקולות של RNA גנומי בהרכב החלקיק הנגיפי הנוצר. מולקולת הפוליפרוטאין עוברת בתחילה דימריזציה עקב האינטראקציה של תחומי המטריצה. לאחר מכן, הדימרים מתאחדים לקומפלקסים הקסמריים (של 6 יחידות) כתוצאה מהאינטראקציה של תחומי CA ו-NC. לבסוף, ההקסמרים, המתאחדים במשטחים הצדדיים שלהם, יוצרים ויריונים כדוריים לא בשלים, שבתוכם נמצא ה-RNA הגנומי הנגיפי, הלכוד על ידי תחום NC.
חלבון מקדים נוסף, Prl60Gag-Pol (חלבון בעל משקל מולקולרי של 160 kDa), מסונתז כתוצאה מהזזת מסגרת על ידי הריבוזום במהלך תרגום הקצה ה-3' של גן gag באזור הממוקם מיד במעלה הזרם של האזור המקודד לחלבון rb. פוליפרוטאין Gag-Pol זה מכיל רצף חלבון Gag לא שלם (1-423 חומצות אמינו) ורצפי Pol הכוללים את הדומיינים PR, RT ו-IN. מולקולות פוליפרוטאין Gag-Pol מסונתזות גם הן על פוליריבוזומים חופשיים ומועברות לממברנת הפלזמה. פוליפרוטאין Prl60Gagpol מכיל את כל אתרי האינטראקציה הבין-מולקולרית ואתרי הקישור לממברנה הטבועים בפוליפרוטאין Gag. לכן, מולקולות פוליפרוטאין Gag-Pol מתמזגות עם הממברנה, ויחד עם מולקולות Gag, נכללות בויריונים הנוצרים, וכתוצאה מכך מופיעה פרוטאז פעילה ותחילת תהליך התבגרות הויריונים. פרוטאז HIV-1 פעיל מאוד רק בצורה של דימר, לכן, לצורך כריתה עצמית מ-Prl60Gag-Pol, נדרשת דימריזציה של מולקולות אלו. התבגרות הוויריון מורכבת מהעובדה שהפרוטאז הפעיל המשתחרר חותך את prl60Gag-Pol ו-Gag55 באתרים שהוא מזהה; נוצרים חלבונים p17, p24, p7, p6, רברטאז ואינטגראז ומתרחשת שיוך שלהם למבנה הוויראלי.
חלבון ה-Env מסונתז על ריבוזומים הקשורים לממברנות הרשת האנדופלסמית, לאחר מכן הוא עובר גליקוזילציה, נחתך על ידי פרוטאז תאי ל-gp120 ו-gp41, ומועבר אל פני התא. במקרה זה, gp41 חודר את הממברנה ונקשר לתחומי המטריצה של מולקולת חלבון Gag הקשורה לפני השטח הפנימיים של הממברנה. קשר זה נשמר בויריון הבוגר.
לפיכך, הרכבת חלקיקי הנגיף מורכבת מהצטברות של חלבוני קדם ומולקולות RNA קשורות על קרום הפלזמה של תא המארח, היווצרות ויריונים לא בשלים ושחרורם על ידי הנצה מפני התא. במהלך ההנצה, הוויריון עוטף את עצמו בקרום תא שאליו משובצות מולקולות gp41 ו-gp120. במהלך ההנצה, או אולי לאחר שחרור הווירונים, מתרחשת התבגרותם, המתבצעת בעזרת פרוטאז ויראלי וכוללת חיתוך פרוטאוליטי של חלבוני הקדם Pr55Gag ו-Prl60Gag-Pol לחלבונים של הנגיף הבוגר וקישורם לקומפלקסים מבניים מסוימים. את התפקיד המוביל בתהליכי המורפוגנזה הוויראלית ממלא הפוליפרוטאין Pr55Gag, המארגן ומרכיב את הוויריון הלא בשל; תהליך ההתבגרות שלו מושלם על ידי פרוטאז ויראלי ספציפי.
גורמים לחוסר חיסוני
אחת הסיבות העיקריות לחוסר חיסוני בזיהום HIV היא מוות המוני של תאי T עוזרים. זה קורה כתוצאה מהאירועים הבאים. ראשית, תאי T עוזרים נגועים בנגיף מתים עקב אפופטוזיס. ההערכה היא שבחולי איידס, שכפול נגיפי, אפופטוזיס וירידה במספר תאי T עוזרים קשורים זה בזה. שנית, תאי T רוצחים מזהים ומשמידים תאי T נגועים בנגיף או נושאים מולקולות gpl20 ספוחות, כמו גם תאי T עוזרים נגועים בנגיף ולא נגועים בנגיף, היוצרים סימפלסטים (סינסיטיום) המורכבים מכמה עשרות תאים (חלקם מתים כתוצאה מהתרבות הנגיפים בהם). כתוצאה מהרס מספר רב של תאי T עוזרים, יש ירידה בביטוי קולטני הממברנה בלימפוציטים B לאינטרלוקין-2, הסינתזה של אינטרלוקינים שונים (גורמי גדילה והתמיינות של לימפוציטים B - IL-4, IL-5, IL-6 וכו') מופרעת, וכתוצאה מכך מופרעת תפקוד מערכת ה-T רוצחים. פעילות מערכות המשלים והמקרופאגים מדוכאת. מקרופאגים ומונוציטים הנגועים בנגיף אינם מתים במשך זמן רב, אך הם אינם מסוגלים להוציא את הנגיף מהגוף. לבסוף, בשל הדמיון המבני והאנטיגני של gpl20 עם קולטנים של חלק מתאי האפיתל בגוף (כולל קולטני טרופובלסטים המתווכים את העברת HIV בהשתלה), מסונתזים נוגדנים נוגדי קולטן בעלי טווח פעולה רחב. נוגדנים כאלה מסוגלים לחסום קולטנים תאיים שונים ולסבך את מהלך המחלה עם הפרעות אוטואימוניות. התוצאה של זיהום HIV היא התבוסה של כל החוליות העיקריות של מערכת החיסון. חולים כאלה הופכים לחסרי הגנה מפני מגוון רחב של מיקרואורגניזמים. זה מוביל להתפתחות של זיהומים אופורטוניסטיים וגידולים. עבור חולים עם זיהום HIV, הסיכון לפתח לפחות שלושה סוגי סרטן עולה: סרקומה של קפוסי; קרצינומה (כולל סרטן עור); לימפומה של תאי B, המתרחשת עקב טרנספורמציה ממאירה של לימפוציטים של תאי B. עם זאת, HIV אינו רק לימפוציטוטרופי, אלא גם נוירוטרופי. הוא חודר לתאי מערכת העצבים המרכזית (אסטרוציטים) הן באמצעות אנדוציטוזה בתיווך קולטנים והן באמצעות פגוציטוזה של לימפובלסטים נגועים בנגיף על ידי אסטרוציטים. כאשר הנגיף מקיים אינטראקציה עם אסטרוציטים, נוצרים גם סימפלסטים, אשר מקלים על התפשטות הפתוגן דרך ערוצים בין-תאיים. הנגיף יכול להתקיים במקרופאגים ובמונוציטים במשך זמן רב, ולכן הם משמשים כמאגר ומפיצים שלו בגוף, ויכולים לחדור לכל הרקמות. מקרופאגים נגועים ממלאים תפקיד מרכזי בהחדרת HIV למערכת העצבים המרכזית ובנזקיה. ב-10% מהחולים, תסמונות קליניות ראשוניות קשורות לנזק למערכת העצבים המרכזית ומתבטאות כדמנציה. לפיכך, אנשים נגועים ב-HIV מאופיינים ב-3 קבוצות של מחלות - זיהומים אופורטוניסטיים,מחלות גידול ופגיעה במערכת העצבים המרכזית.
אפידמיולוגיה של זיהום HIV
מקור ההדבקה ב-HIV הוא אדם בלבד - אדם חולה או נשא של הנגיף. נגיף הכשל החיסוני האנושי (HIV) נמצא בדם, בזרע ובנוזל צוואר הרחם; אצל אמהות מניקות - בחלב אם. ההדבקה מתרחשת מינית, דרך דם ותכשיריו, וכן מאם לילד לפני, במהלך ואחרי הלידה. מקרים של הדבקה בנגיף דרך מזון, משקאות ועקיצות חרקים אינם ידועים.
התמכרות לסמים תורמת להתפשטות איידס. שכיחות מקרי ה-HIV גדלה מדי שנה. על פי ארגון הבריאות העולמי, בין השנים 1980 ל-2000, 58 מיליון בני אדם נדבקו ב-HIV. בשנת 2000 לבדה, 5.3 מיליון בני אדם נדבקו ברחבי העולם, ו-3 מיליון בני אדם מתו מאיידס. נכון ל-1 בינואר 2004, 264 אלף נגועי HIV נרשמו ברוסיה. מחצית מהאנשים הנדבקים ב-HIV מתים תוך 11-12 שנים מרגע ההדבקה. בתחילת 2004, מתוך כל 100 אלף אזרחי רוסיה, כ-180 חיו עם אבחנה של "הדבקה ב-HIV". ההערכה היא שעם רמת תחלואה זו, המספר הכולל של נגועי HIV ברוסיה עד 2012 יעמוד על 2.5-3 מיליון בני אדם. מורכבות המאבק בזיהום HIV תלויה במספר סיבות: ראשית, אין שיטות יעילות לטיפול ולמניעה ספציפית; שנית, תקופת הדגירה של זיהום HIV יכולה לעלות על 10 שנים. משכו תלוי ברגע הפעלת הלימפוציטים T והפרו-וירוס DNA הכלול בכרומוזום שלו. עדיין לא ברור האם כל מי שנדבק בווירוס נידון לאיידס או שמא נשאות ארוכת טווח של הווירוס ללא מחלה אפשרית (מה שנראה לא סביר). לבסוף, ישנם מספר נגיפי כשל חיסוני אנושי (HIV-1, HIV-2), שההבדלים האנטיגניים ביניהם מונעים היווצרות חסינות צולבת. גילוי נגיף הכשל החיסוני הקופי (SIV) שפך אור על שאלת מקור ה-HIV. SIV דומה ל-HIV בארגון הגנום שלו, אך שונה באופן משמעותי ברצף הנוקלאוטידים שלו. HIV-2 תופס עמדה ביניים בין HIV-1 ל-SIV בתכונות הסרולוגיות שלו, וקרוב יותר ל-SIV ברצף הנוקלאוטידים שלו. בהקשר זה, VM Zhdanov הציע כי נגיפי HIV-1, HIV-2 ו-SIV מקורם באב קדמון משותף. ייתכן, על פי ר. גאלו, שאחד מ-SIV חדר איכשהו לגוף האדם, שם עבר סדרה של מוטציות, וכתוצאה מכך הופעתם של HIV-1, HIV-2 וצורותיו האחרות.
תסמינים של זיהום HIV
לנגיף הכשל החיסוני האנושי יש כמה מאפיינים הקובעים במידה רבה את הפתוגנזה של המחלה. לנגיף קצב רבייה גבוה מאוד, הנקבע על ידי אלמנטים הרגולטוריים שלו (עד 5,000 ויריונים מסונתזים תוך 5 דקות בשלב הפעיל). בשל נוכחותו של חלבון ההיתוך (gp41), הנגיף גורם להיווצרות מבנים סינציאליים נרחבים עקב היתוך של עוזרי T נגועים ולא נגועים, מה שמביא למוות המוני שלהם. מולקולות החלבון gpl20 הנוצרות בכמויות גדולות מסתובבות בחופשיות בדם ונקשרות לקולטנים של עוזרי T לא נגועים, וכתוצאה מכך הן מזוהות ונהרסות גם על ידי רוצחי T. הנגיף יכול להתפשט דרך ערוצים בין-תאיים מתא לתא, ובמקרה כזה הוא הופך להיות נגיש לקושי לנוגדנים.
קריטריונים קליניים לזיהום HIV
אצל מבוגרים, זיהום ב-HIV מאובחן כאשר יש להם לפחות שני תסמינים חמורים בשילוב עם לפחות תסמין אחד מינורי ובהיעדר סיבות ידועות אחרות לחוסר חיסוני (סרטן, חוסר חיסוני מולד, רעב חמור וכו'). תסמינים חמורים כוללים:
- ירידה במשקל של 10% או יותר;
- מצב חום ממושך, לסירוגין או קבוע;
- שלשול כרוני.
תסמינים קלים: שיעול מתמשך, דלקת עור מוכללת, הרפס זוסטר חוזר, קנדידה בחלל הפה והלוע, הרפס סימפלקס כרוני, לימפדנופתיה מוכללת. אבחון איידס נעשה בנוכחות סרקומה של קפוסי בלבד, דלקת קרום המוח קריפטוקוקלית, דלקת ריאות פנאומוציסטיס. התמונה הקלינית של המחלה מושפעת מהזיהום האופורטוניסטי הנלווה.
שיטות לגידול נגיף הכשל החיסוני האנושי (HIV)
ניתן לגדל HIV-1 ו-HIV-2 בתאים של שיבוט אחד בלבד של לימפוציטים מסוג TCV4 - H9, המתקבל מלימפוציטים מסוג TCV4 לויקמיים. ניתן להשתמש גם בתרביות חד-שכבתיות של תאי אסטרוציטים, שבהן HIV-1 מתרבה היטב, למטרות אלה. שימפנזים רגישים ל-HIV-1 בקרב בעלי חיים.
עמידותו של הנגיף בסביבה החיצונית נמוכה. הוא מת תחת השפעת אור השמש וקרינת UV, מושמד ב-80 מעלות צלזיוס תוך 30 דקות, וכאשר מטפלים בו בחומרי חיטוי נפוצים - תוך 20-30 דקות. לחיטוי חומר המכיל נגיף, יש צורך להשתמש בחומרי חיטוי קוטלי מיקובקטריות, מכיוון שהם יעילים כנגד מיקרואורגניזמים בעלי העמידות הגבוהה ביותר.
אבחון מעבדתי של זיהום HIV
השיטה העיקרית לאבחון נשאות נגיף וזיהום ב-HIV היא אימונו-אסאי אנזימטי. עם זאת, בשל העובדה של-gpl20 יש דמיון מבני ואנטיגני לקולטנים של חלק מהתאים האנושיים, כולל קולטנים המובילים אימונוגלובולינים דרך תאי אפיתל של הריריות הריריות, נוגדנים הקשורים לנוגדנים כנגד gpl20 עשויים להופיע בגוף. במקרה זה, ייתכנו תוצאות ELISA חיוביות שגויות. לכן, כל הסרום המגיב החיובי של הנבדקים עובר ניתוח נוסף באמצעות שיטת אימונובלוטינג, או Western blotting. שיטה זו מבוססת על זיהוי הנוגדנים הנחקרים לאחר הפרדתם האלקטרופורטית ובדיקה שלאחר מכן באמצעות נוגדנים אנטי-מיניים מסומנים. השיטה הווירולוגית נמצאת בשימוש לעתים רחוקות עקב מורכבות גידול הנגיף. שיבוט הלימפוציטים H9 משמש להשגת אנטיגנים ויראליים - המרכיבים הדרושים של מערכות בדיקה אבחנתיות. שיטת CPR מאפשרת גילוי הנגיף בשלב מוקדם של וירמיה.
טיפול בזיהום HIV
יש צורך למצוא או לסנתז תרופות שמדכאות ביעילות את פעילות הטרנסקריפטאז הרוורס (רברטאז) או פרוטאז ויראלי. הן ימנעו את היווצרות הפרו-וירוס DNA ו/או יעכבו את ההתרבות התוך-תאית של הווירוס. האסטרטגיה המודרנית לטיפול בחולי HIV מבוססת על עקרון השימוש המשולב בתרופות המעכבות פרוטאז ויראלי (אחת התרופות) ורברטאז (2 תרופות שונות) - טיפול משולב (משולש). ברוסיה, לטיפול בחולי HIV, מומלץ שימוש משולב בשתי תרופות מקומיות: פוספזיד וקריקסיוון, אשר מדכאות באופן ספציפי את ההתרבות של HIV בשלבים מוקדמים ומאוחרים של ההתרבות, במיוחד עם פעילות מופחתת של אזידותימידין.
בעיית המניעה הספציפית היא הצורך ליצור חיסון שיבטיח היווצרות חסינות תאית יעילה המבוססת על לימפוציטים ציטוטוקסיים ספציפיים לנגיף ללא ייצור משמעותי של נוגדנים. חסינות כזו מסופקת על ידי עוזרי Thl. ייתכן שנוגדנים, כולל נוגדנים מנטרלי וירוסים, לא רק אינם יעילים בדיכוי זיהום HIV, אלא שברמה גבוהה הם מדכאים חסינות תאית. לכן, חיסון נגד HIV חייב לעמוד, קודם כל, בשתי דרישות עיקריות: א) להיות בטוח לחלוטין ו-ב) לעורר את פעילותם של לימפוציטים ציטוטוקסיים מסוג T. נחקרת יעילותם של גרסאות חיסון שונות המתקבלות מווירוסים מומתים (לא פעילים) ומאנטיגנים בודדים בעלי תכונות הגנה גבוהות. ניתן לבודד אנטיגנים כאלה מהווירוסים עצמם או לסנתז אותם כימית. הוצע חיסון שנוצר על בסיס שיטות הנדסה גנטית. זהו נגיף vaccinia רקומביננטי הנושא גנים של HIV האחראים לסינתזה של אנטיגנים בעלי תכונות אימונוגניות חזקות. שאלת יעילותם של חיסונים אלה דורשת זמן רב עקב תקופת הדגירה הארוכה של זיהום HIV והשונות הגבוהה של הפתוגן. יצירת חיסון יעיל ביותר נגד HIV היא בעיה מהותית דחופה.

