המומחה הרפואי של המאמר
פרסומים חדשים
כלבת אצל ילדים
סקירה אחרונה: 04.07.2025

כל תוכן iLive נבדק מבחינה רפואית או נבדק למעשה כדי להבטיח דיוק עובדתי רב ככל האפשר.
יש לנו קווים מנחים קפדניים המקור רק קישור לאתרים מדיה מכובד, מוסדות מחקר אקדמי, בכל עת אפשרי, עמיתים מבחינה רפואית מחקרים. שים לב שהמספרים בסוגריים ([1], [2] וכו ') הם קישורים הניתנים ללחיצה למחקרים אלה.
אם אתה סבור שתוכן כלשהו שלנו אינו מדויק, לא עדכני או מפוקפק אחרת, בחר אותו ולחץ על Ctrl + Enter.
כלבת, או הידרופוביה, היא מחלה נגיפית חריפה המועברת דרך נשיכה של בעל חיים נגוע, עם פגיעה במערכת העצבים והתפתחות דלקת מוח קשה עם תוצאה קטלנית.
אֶפִּידֶמִיוֹלוֹגִיָה
נגיף הכלבת, ששימש כמגפה בריאותית ציבורית מימי קדם, גורם כיום לכ-59,000 מקרי מוות של בני אדם מדי שנה, שכמעט כולם מועברים על ידי נשיכות כלבים. לנגיף זה יש השפעה כלכלית משמעותית על מדינות מתפתחות, ובמיוחד באפריקה ובאסיה, אשר יכולות לשאת את ההפסדים הנמוכים ביותר. עם זאת, למרות שיעור התמותה של כמעט 100%, כלבת בכלבים היא מחלה שניתן למנוע לחלוטין, ודוגמאות היסטוריות של מיגור כלבת בכלבים בעולם המפותח מעידות על כך. [ 1 ]
גורם ל כַּלֶבֶת
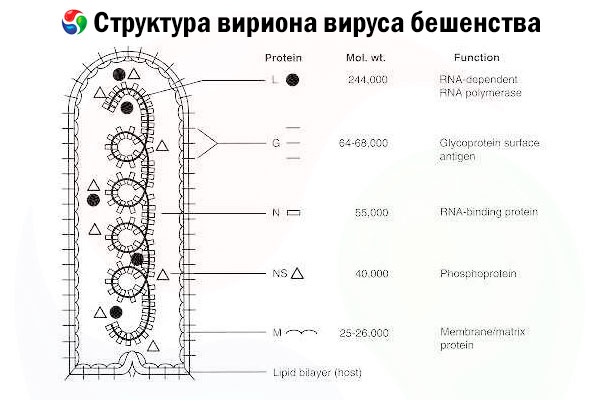
הגורם למחלה הוא נגיף הכלבת (RV), נגיף RNA בעל גדיל שלילי ממשפחת הרבדווירוסים, בגודל של כ-60 ננומטר × 180 ננומטר.
הוא מורכב מליבת חלבון פנימית, או נוקלאוקפסיד, המכילה חומצת גרעין, וממברנה חיצונית, שכבה דו-שכבתית המכילה ליפידים המכוסה בקצוות גליקופרוטאין טרנסממברנליים. יש לו מבנה גנום מודולרי פשוט יחסית והוא מקודד חמישה חלבונים מבניים:
- RNA פולימראז תלוי RNA (L),
- נוקלאופרוטאין (N),
- חלבון זרחני (P),
- חלבון מטריקס (M) ו
- גליקופרוטאין (G) על פני השטח החיצוניים.
חלבוני N, P ו-L יחד עם ה-RNA הגנומי יוצרים את קומפלקס הריבונוקלאופרוטאין. G הוא האנטיגן היחיד של תאי RV המסוגל לגרום לייצור נוגדנים מנטרלי תאי RV, שהם הגורמים החיסוניים העיקריים כנגד זיהום קטלני של תאי RV. מצד שני, קומפלקס הריבונוקלאופרוטאין הוכח כאנטיגן העיקרי של תאי RV המסוגל לגרום לתאי T מסוג CD4+, שיכולים לשפר את ייצור הנוגדנים מנטרלי תאי RV באמצעות זיהוי אנטיגן תוך-מבני. [ 2 ] קומפלקס הריבונוקלאופרוטאין עשוי למלא תפקיד חשוב ביצירת זיכרון חיסוני וחסינות ארוכת טווח. [ 3 ]
סיווג וסוגי אנטיגנים
הסוג ליסהווירוס כולל את נגיף הכלבת ונגיפי כלבת הקשורים אנטיגנית וגנטית: נגיפי עטלפים לאגוס, מוקולה ודובנהאגה, כמו גם שני תת-סוגים משוערים של ליסווירוסי עטלפים אירופאים. מחקרי הגנה צולבת מצביעים על כך שבעלי חיים שחוסנו בחיסוני כלבת מסורתיים עשויים שלא להיות מוגנים לחלוטין כאשר הם נחשפים לליסהווירוסים אחרים.
ניתן לסווג נגיפי כלבת כקבועים (מותאמים על ידי מעבר בבעלי חיים או בתרבית תאים) או כנגיפים מסוג רחוב (סוג בר). השימוש בנוגדנים חד שבטיים וריצוף גנטי כדי להבדיל בין נגיפי כלבת מסוג רחוב סייע בזיהוי וריאנטים ויראליים שמקורם במאגרים מרכזיים של מארחים ברחבי העולם ובהצעת מקורות אפשריים לחשיפה אנושית כאשר היסטוריה של נשיכה חד משמעית של בעל חיים נעדרה במקרה של חולה.[ 8 ]
פתוגנזה
המאגר העיקרי ומקור ההדבקה בקרב חיות בר הם זאבים, שועלים, תנים, עטלפים, ובקרב חיות בית - כלבים וחתולים, לעיתים רחוקות - סוסים, בקר, חזירים, חולדות וכו'. העברת הזיהום מאדם לאדם, למרות שאפשרית, היא נדירה ביותר. זהו זיהום זואונוטי טיפוסי. אנשים נדבקים בכלבת בעיקר מכלבים.
לאחר שאדם ננשך על ידי בעל חיים חולה, הנגיף מתרבה ברקמת השריר במקום הנשיכה, ולאחר מכן, לאחר שהגיע לקצות העצבים ההיקפיים התחושתיים, מתפשט בצנטריפטליה ומגיע לנוירונים המוטוריים. הזמן שלוקח לנגיף לנוע ולמוח להיפגע תלוי באתר הנשיכה. במקרה של נשיכות קשות של הראש והפנים, הנגיף יכול להגיע למערכת העצבים המרכזית תוך 15-20 יום, ובמקרה של נזק קל לעור הגוף והגפיים, וכתוצאה מכך, מינון קטן של הפתוגן, תהליך העברת הנגיף למערכת העצבים המרכזית יכול להתעכב במספר חודשים או אפילו עד 1-1.5 שנים. לאחר שהגיע למערכת העצבים המרכזית, הנגיף מתקבע ברקמות המוח וחוט השדרה, בעיקר בנוירונים של לשד המוארך, קרן עמון ובסיס המוח. בחוט השדרה, הקרניים האחוריות מושפעות ביותר. ממערכת העצבים המרכזית, הנגיף מגיע בצנטריפוגלית לאורך גזעי העצבים לבלוטות הרוק, שם הוא מתרבה ומופרש עם הרוק.
מושגים בפתוגנזה של כלבת
לנגיף RV מגוון רחב של פונדקאים והוא יכול להדביק כמעט את כל היונקים. למרות שדווחו על מספר דרכי הדבקה של נגיף RV, הדבקה טבעית מתרחשת לרוב באמצעות נשיכה. בנוסף לנשיכות, צריכת גופות נגועים בנגיף RV יכולה לקדם הדבקה בנגיף הכלבת בשועלים ארקטיים, ומגע של נגיף RV עם ריריות נמצא כדרך הדבקה אפשרית נוספת.[ 9 ] בנסיבות יוצאות דופן, כגון שחרור מקרי של נגיף RV כתרסיס במעבדה או נגיף RV כתרסיס במערות המאוכלסות על ידי מספר רב של עטלפים,[ 10 ] עלולה להתרחש העברת תרסיס.
עדיין לא ברור האם זני RV רחוב וזני RV שעברו התאמה לעכברים או לתרבית רקמה משכפלים באתר ההזרקה לפני שהם נכנסים למערכת העצבים המרכזית. בעוד שזיהום תוך שרירי ניסיוני של אוגרים או דביבונים צעירים עם RV רחוב גילה שכפול של RV בתאי שריר משורטטים לפני שהנגיף פלש לאקסונים של נוירונים מוטוריים דרך צמתים עצביים-שריריים,[ 11 ],[ 12 ] זיהום תוך שרירי של עכברים עם RV CVS-24 שעבר התאמה לעכברים הראה ש-RV נודד ישירות למערכת העצבים המרכזית ללא שכפול מוקדם באתר ההזרקה.[ 13 ] לאחר שהגיע לטרמינלים של אקסונים לא מיאלינים, RV מועבר באופן רטרוגרדי לגוף התא.
ממצאים אחרונים מצביעים על כך שתעבורת שלפוחיות אקסונליות עשויה לייצג אסטרטגיה מרכזית לתנועת וירונים למרחקים ארוכים באקסונים.[ 14 ] ההערכה היא ש-RV נודד בתוך אקסונים בקצב של 3 מ"מ/שעה.[ 15 ] לאחר מכן הזיהום מתפשט דרך שרשרת של נוירונים המחוברים באמצעות צמתים סינפטיים. עם זאת, המנגנון המדויק המקדם התפשטות טרנס-סינפטית עדיין אינו ידוע. לאחר הדבקת המוח, הנגיף מתפשט באופן צנטריפוגלי למערכת העצבים ההיקפית והאוטונומית באיברים היקפיים רבים.[ 16 ] בשלב האחרון של מחזור ההדבקה, RV נודד לבלוטות הרוק; לאחר שכפול בתאים אצינריים מוקוגניים, הוא משתחרר לרוק ומוכן להעברה לפונדקאי הבא.[ 17 ]
בנוגע לפתולוגיה הנגרמת על ידי נגיף הכלבת, הוצע מוות תאי אפופטוטי כמנגנון פתוגני פוטנציאלי במודלים ניסיוניים של כלבת בעכברים שנדבקו בזן קבוע של חדר ימין.[ 18 ] מנגנון פתוגני שעשוי לתרום לתפקוד לקוי עמוק של מערכת העצבים המרכזית המאפיינת כלבת עשוי להיות פגיעה בתפקוד העצבי. ביטוי גנים הוכח כמופחת באופן ניכר בנוירונים נגועים ב-RV, וכתוצאה מכך דיכוי כללי של סינתזת חלבונים,[ 19 ] ומספר מחקרים הראו פגיעה בתפקוד הנוירוטרנסמיסיה לאחר זיהום ב-RV. ג'יאנג הדגים כי קשירת אנטגוניסט לקולטן אצטילכולין להומוגנטים של מוח חולדה נגועים פחתה בהשוואה לקבוצת הביקורת.[ 20 ] שחרור וקשירה לקויים של סרוטונין, נוירוטרנסמיטר המעורב בשליטה על מחזור השינה, תפיסת כאב והתנהגות, נצפו גם במוח חולדה נגוע ב-RV. [ 21 ], [ 22 ] בנוסף להשפעה על הנוירוטרנסמיסיה, זיהום בחדר ימין עשוי להשפיע גם על תעלות יונים. תאי נוירובלסטומה של עכברים נגועים מפגינים ירידה בביטוי תפקודי של תעלות נתרן תלויות מתח, מה שעשוי למנוע פוטנציאלי פעולה ובסופו של דבר להוביל לפגיעה תפקודית. [ 23 ]
בנוסף להיעדר נגעים פתולוגיים חמורים במערכת העצבים המרכזית, רוב מקרי הכלבת בבני אדם אינם מעוררים תגובה חיסונית 7 עד 10 ימים לאחר הופעת הסימנים הקליניים. הבדלים עמוקים אלה בין הפתוגנזה של כלבת לבין זו של רוב זיהומים נגיפיים או חיידקיים אחרים במערכת העצבים המרכזית נתמכים עוד יותר על ידי העובדה שדיכוי חיסוני אינו יעיל או מזיק לתוצאות הכלבת. [ 24 ] הרמה הנמוכה של תגובה חיסונית הנצפית לעתים קרובות אצל קורבנות כלבת היא תמוהה מכיוון שלא ניתן להסביר אותה על ידי האימונוגניות הירודה של אנטיגנים של RV. למעשה, חלבון G של RV וחלבון נוקלאוקפסיד הם אנטיגנים חזקים של תאי B ו-T כאשר הם ניתנים באופן פרנטרלי. [ 25 ] הסבר אפשרי לרמה הנמוכה של תגובה חיסונית כנגד RV בבני אדם או בבעלי חיים עם כלבת עשוי להיות שזיהום RV במערכת העצבים המרכזית גורם לדיכוי חיסוני, [ 26 ] והוצע כי RV משתמש באסטרטגיה חתרנית הכוללת מניעת אפופטוזיס והשמדת תאי T פולשים. [ 27 ]
זני RV מוחלשים שהותאמו לתאים שאינם עצביים נבדלים באופן משמעותי מזני RV פתוגניים בנוירו-פולשנות שלהם, המתייחסת ליכולתם לפלוש למערכת העצבים המרכזית מאתרים פריפריאליים. בהקשר זה, זני RV שהותאמו לתרבית רקמה חסרים או בעלי יכולת מוגבלת בלבד לפלוש למערכת העצבים המרכזית מאתרים פריפריאליים, בעוד שזני RV רחוב או זני RV שהותאמו לעכברים כמו CVS-24 הם פולשניים ביותר.[ 28 ] גורמים מרכזיים המעורבים בנוירו-פלישה של RV כוללים ספיגה נגיפית, הובלה אקסונלית, התפשטות טרנס-סינפטית וקצב שכפול נגיפי.
עד לאחרונה, הידע שלנו על הפתוגנזה של חיידק ה-RV היה מוגבל והתבסס בעיקר על מחקרים תיאוריים של זני חיידק ה-RV ברחוב או זיהומים ניסיוניים עם זנים מוחלשים שעובדו במעבדה. הופעת טכנולוגיית הגנטיקה ההפוכה אפשרה לנו לזהות את האלמנטים הוויראליים הקובעים את הפנוטיפ הפתוגני של חיידק ה-RV ולהבין טוב יותר את המנגנונים המעורבים בפתוגנזה של כלבת.
זיהוי גורמים נגיפיים השולטים ברכישה, הפצה ושכפול של נגיף הכלבת
- אלמנטים נגיפיים המעורבים בלכידת וירוסים
זיהום בנגיף הכלבת מתחיל בהיצמדות הנגיף לקולטן תאי משוער. למרות שמספר מולקולות על פני הממברנה הוצעו כקולטני נגיף הכלבת, כולל קולטן האצטילכולין הניקוטי,[ 29 ] מולקולת הידבקות תאים עצביים[ 30 ] וקולטן הנוירוטרופין p75 NTR בעל זיקה נמוכה,[ 31 ] עדיין לא ברור האם מולקולות אלו אכן ממלאות תפקיד במחזור החיים של נגיף הכלבת. בהקשר זה, הוכח לאחרונה כי האינטראקציה בין נגיף הכלבת G ל-p75 NTR אינה נדרשת להדבקה בנוירונים ראשוניים של נגיף הכלבת.[ 32 ] לאחר קשירת הקולטן, נגיף הכלבת מופנם באמצעות אנדוציטוזה ספיחה או בתיווך קולטן.[ 33 ] סביבת ה-pH הנמוכה בתוך התא האנדוזומי גורמת לאחר מכן לשינויים קונפורמציוניים בנגיף הכלבת G המפעילים איחוי של קרום הנגיף עם קרום האנדוזום, ובכך משחררים את ה-RNP לציטופלזמה.[ 34 ] עבור נגיפים, נגיף הכלבת G ממלא תפקיד קריטי בקליטה נגיפית, ככל הנראה באמצעות אינטראקציות עם קולטנים תאיים משוערים המאפשרים קליטה מהירה. בהקשר זה, הוכח כי הפתוגניות של זני RV שהותאמו לתרבית רקמה (למשל, ERA, HEP ו-CVS-11) מתואמת עם נוכחותו של דטרמיננט הממוקם באתר אנטיגני III של חלבון G. [ 35 ] מוטציה Arg → Gln במיקום 333 באתר אנטיגני זה של חלבון G ERA הביאה לעיכוב פי שבעה בהפנמה של וריאנט Gln333 RV בהשוואה לוריאנט הבר. המוטציה Asn194→Lys194 בנגיף RV G, המסבירה את הופעתו המחודשת של הפנוטיפ הפתוגני, נקשרה לירידה משמעותית בזמן ההפנמה.[ 36 ] יתר על כן, ניסויים עם נגיפים כימריים של נגיפים RV הראו כי הזמן הנדרש להפנמה של ויריונים של נגיף RV גדל משמעותית והפתוגניות פחתה מאוד לאחר החלפת הגן G של זן SB RV הפתוגני ביותר, אשר נגזר משיבוט cDNA של זן RV-18 הקשור לעטלף שמקורו בכסף,[ 37 ] בזה של זן SN המוחלש ביותר, אשר בודד משיבוט cDNA של זן החיסון SAD B19 RV.[ 38 ] יחד, נתונים אלה תומכים ברעיון שהקינטיקה של ספיגת הנגיף, שהיא פונקציה של RV G, היא גורם מכריע בפתוגניות של נגיפים RV.
- אלמנטים נגיפיים המעורבים בהתפשטות ובהעברה של נגיפים
תכונה ייחודית של נגיף הכלבת היא יכולתו להתפשט מתא לתא. התצפית שווריאנט Gln333 ERA מאבד פעילות איחוי תא-תא תלוית-pH במבחנה [ 39 ] ומציג יכולת מופחתת מאוד להתפשט מתא לתא [ 40 ] מצביעה על כך שגם ל-RV G תפקיד מפתח בהתפשטות מתא לתא ולכן בהעברה של הנגיף, ככל הנראה באמצעות פעילותו ההיתוך-גונית. אפשרות זו נתמכת עוד יותר על ידי הממצא שקצב ההתפשטות של SPBNGAK הפתוגני החוזר ל-RV גבוה כמעט פי שניים מזה שנקבע עבור הווריאנט הלא-פתוגני SPBNGA. מעניין לציין, שהמוטציה Asn 194 → Lys 194 ב-G SPBNGAK גרמה לשינוי בסף ה-pH לאיחוי ממברנה ל-pH גבוה יותר, דבר התומך בהשערה שסף pH גבוה יותר לאיחוי ממברנה קשור להתפשטות מוגברת של הנגיף. [ 41 ]
מחקרים על אינדיקטורים טרנס-נוירונים של זיהום ב-RV בחולדות [ 42 ] וקופי רזוס [ 43 ] הראו כי נגיף הכלבת נודד אך ורק בכיוון רטרוגרדי באקסונים. למרות שמספר חלבוני RV מעורבים במנגנוני הובלה עצביים, נראה כי ל-RV G תפקיד מרכזי בהתפשטות טרנס-נוירונית של זיהום ב-RV. לדוגמה, בעוד שזיהום היקפי עם נגיף אנמיה זיהומית סוסית (EIAV) שסומן ב-RV G גורם למעבר נגיפי לחוט השדרה, אותו EIAV שסומן ב-Vesicular Stomatitis Virus G לא הצליח להיכנס למערכת העצבים. [ 44 ] יתר על כן, נמצא כי התפשטות נגיפית של המוטציה ERA G Arg 333 → Gln 333 במערכת העצבים המרכזית הייתה מופחתת מאוד בהשוואה למוטציה מהסוג הבר, דבר המצביע עוד על פונקציה של RV G שלם בהתפשטות טרנס-סינפטית. עם זאת, הראיות המשכנעות ביותר לתפקיד חשוב של RV G בתעבורה טרנס-סינפטית מגיעות מזיהום תוך-גולגולתי של עכברים עם וירוס RV חסר G רקומביננטי, שהראה כי הזיהום נותר מוגבל לנוירונים באתר ההזרקה ללא כל עדות להתפשטות לנוירונים משניים.[ 45 ] עם זאת, סביר להניח שבנוסף ל-RV G, גם RV M ממלא תפקיד בהתפשטות הווירוס ולכן בתעבורה טרנס-סינפטית. בהקשר זה, הוכח כי התפשטות הווריאנט הכימרי SN-BMBG RV, המכיל גם M וגם G מה-SB הפתוגני ביותר, הייתה גבוהה משמעותית מהתפשטות הווריאנט הכימרי SN-BG או SN-BM, המכילים את G ו-M מ-SB, בהתאמה, דבר המצביע על כך שאינטראקציה אופטימלית של M עם G עשויה למלא תפקיד חשוב בהתפשטות הווירוס מתא לתא. [ 46 ] מכיוון ש-RV M תומך בהנבת וירוסים, [ 47 ] סביר להניח שההתפשטות היעילה יותר של הווריאנט הכימרי SN-BMBG RV נובעת מהנבת וירוס אופטימלית בקרום הפוסט-סינפטי.
מחקרים אחרונים הראו כי האינטראקציה בין חלבון RV P לבין שרשרת האור של דיניאין מקשרת את ה-RNP של RV למערכת ההובלה של תא המארח, ובכך מקלה על הובלה אקסונלית רטרוגרדית של הנגיף. [ 48 ], [ 49 ] עם זאת, זיהום היקפי של עכברים בוגרים הראה כי מחיקת תחום הקישור LC8 של חלבון RV P אינה מונעת כניסת נגיף למערכת העצבים המרכזית, דבר המצביע על כך שחלבון ה-RV אינו מעורב ישירות בהתפשטות אקסונלית רטרוגרדית של RV. [ 50 ]
- אלמנטים נגיפיים השולטים בשכפול הנגיף
בניגוד לווירוסים רבים אחרים, כמו נגיף השפעת, הפתוגניות של נגיפי ראבדוס (RV) נמצאת ביחס הפוך לקצב סינתזת ה-RNA הנגיפי וייצור חלקיקים נגיפיים זיהומיים. השוואה בין רמות ה-mRNA הנגיפי וה-RNA הגנומי המיוצרות על ידי וירוסים כימריים שונים מצביעה על כך שתעתוק ושכפול ה-RNA הנגיפי מווסתים על ידי גורמים מרובים, כולל M של נגיפי ראבדוס, אשר זוהה כגורם טרנס-אקטינג המתווך את המעבר מרמות גבוהות של סינתזת mRNA בהתחלה לסינתזת RNA גנומי.[ 51 ] יתר על כן, M מכל נגיפי הרבדוס מסוגל לכבות את ביטוי הגנים הנגיפיים על ידי קשירה ל-RNP, וכתוצאה מכך נוצר מבנה דמוי עמוד שדרה מרוכז מאוד שאינו מסוגל לתמוך בסינתזת RNA.
כדי לזהות אלמנטים ויראליים אחרים השולטים בפתוגניות על ידי ויסות שכפול הנגיף, הרצפים הטרמינליים 5' של זן SB הפתוגני ביותר הוחלפו בהדרגה ברצפים מזן החיסון SN המוחלש ביותר, וכתוצאה מכך נוצרו הנגיפים הרקומביננטיים SB2 (רצף טרמינלי [TS] + L), SB3 (TS + L + פסאודוגן [Ψ]), SB4 (TS + L + Ψ + G), ו-SB5 (TS + L + Ψ + G + M). זיהום תוך-שרירי עם נגיפי ההורים SB ו-SN והנגיפים הכימריים SB2, SB3, SB4 ו-SB5 גרמו לשיעורי התמותה הגבוהים ביותר בעכברים נגועים ב-SB וללא תחלואה או תמותה בעכברים נגועים ב-SN. החלפת TS, L ו-SB באלמנטים המתאימים מ-SN הביאה לירידה צנועה בתחלואה ובתמותה, וחילופי G או G בתוספת M נוספים הפחיתו באופן משמעותי או ביטלו לחלוטין את הפתוגניות הנגיפית.
אפיון פנוטיפי של וריאציות RV כימריות ופראיות RV נתונות נמצא בקורלציה הפוך עם יכולתן להתרבות בתאי עצב. למרות ש-SB השתכפל ברמות נמוכות כמעט פי 1000 מ-SN, והחלפת TS, L, וב-SB על ידי רמות SN השפיעה מעט על קינטיקה של גדילת הנגיף, החלפה נוספת של G או G בתוספת M של SB על ידי גני SN המתאימים הביאה לעלייה של 1-log בייצור הנגיף, דבר המצביע על כך שקינטיקה של שכפול RNA ויראלי כמו גם ייצור חלקיקי הנגיף נשלטים במידה רבה על ידי חלבון G של RV. מסקנה זו נתמכת על ידי נתונים שהתקבלו עם וריאנטים של G של RV הנבדלים בחומצת אמינו אחת בחלבוני ה-G שלהם. הווריאנט הפתוגני של נגיף הכלבת SPBNGAK 194 ייצר טיטר נגיף בתאי NA שהיה נמוך בלוג אחד מזה שנוצר על ידי הווריאנט הלא פתוגני SPBNGAN 194, וניתוח PCR בזמן אמת הראה שקצבי שעתוק ושכפול ה-RNA הנגיפי בתאי NA נגועים ב-SPBNGAK היו גבוהים פי 5 ו-10 מאשר בתאי NA נגועים ב-SPBNGAK.[ 52 ] ראיות נוספות לקורלציה הפוכה בין פתוגניות לבין קצב סינתזת ה-RNA הנגיפי וייצור חלקיקי הנגיף סופקו על ידי עכברים שנדבקו בנגיפים רקומביננטיים כימריים שבהם הגנים G ו-M של זן ה-SN המוחלש הוחלפו באלה של זן ה-SB הפתוגני ביותר. ניסויים אלה גילו עלייה משמעותית בפתוגניות של זן ה-SN ההורי הנושא RV G על פני זן ה-SB הפתוגני. הפתוגניות גדלה עוד יותר כאשר גם G וגם M מ-SB הוכנסו ל-SN.
החלפה של G או M או שניהם ב-SN עם הגנים המתאימים מ-SB נקשרה לירידה משמעותית בקצב ייצור חלקיקי הנגיף וכן בקצב סינתזת ה-RNA הנגיפי. נתונים אלה מצביעים על כך שגם G וגם M ממלאים תפקידים חשובים בפתוגנזה של RV על ידי ויסות שכפול הנגיף. הממצא שהחלפה של G או G בתוספת M ב-SN עם G או G בתוספת M של SB גורמת לירידה בינונית עד חזקה בתעתוק ובשכפול ה-RNA הנגיפי, בהתאמה, בעוד שהחלפה של M בלבד ב-SN עם M של SB גורמת לעלייה חזקה בתעתוק ובשכפול ה-RNA הנגיפי, מצביע על כך של-RV G יש גם תפקיד רגולטורי חשוב בתעתוק/שכפול ה-RNA הנגיפי, לבד או באמצעות אינטראקציה עם חלבון M. המנגנון שבו הגן RV G שולט בסינתזת ה-RNA הנגיפי אינו ידוע. רצפי נוקלאוטידים מסוימים בתוך הגנים של RV G, כגון אלה הכוללים את הקודונים עבור Arg333 ו-Lys 194, זוהו כמטרות עבור miRNAs תאיים. הוכח כי זיהוי מטרות על ידי miRNAs תאיים יכול לגרום לוויסות חיובי או שלילי של שכפול הנגיף. [ 53 ] החלפות של Arg 333 → Glu 333 או Lys 194 → Ser 194 בתוך רצף הגן RV G גורמות לביטול רצפי מטרה של miRNA, אשר בתורם קשורה לעלייה משמעותית בקצב סינתזת ה-RNA הנגיפי [Faber M, אוניברסיטת תומאס ג'פרסון, פנסילבניה, ארה"ב, נתונים שלא פורסמו], דבר המצביע על כך ש-miRNAs תאיים מארחים ממלאים גם הם תפקיד חשוב בוויסות שכפול RV, כפי שהוכח עבור נגיפי RNA אחרים, כולל נגיף דלקת פה שלפוחיתית ו-HCV. [ 54 ], [ 55 ]
נראה כי ויסות שכפול הנגיף הוא אחד המנגנונים החשובים המעורבים בפתוגנזה של נגיפים פתוגניים. כדי להתחמק מתגובה חיסונית ולשמר את שלמות הרשת העצבית, זני נגיפים פתוגניים, אך לא זנים מוחלשים, יכולים לווסת את קצב הגדילה שלהם. קצב שכפול נמוך יותר כנראה מועיל לזני נגיפים פתוגניים על ידי שימור המבנה העצבי בו משתמשים נגיפים אלה כדי להגיע למערכת העצבים המרכזית. הסבר נוסף לקצב השכפול הנמוך יותר של נגיפים פתוגניים הוא שכדי להתחמק מגילוי מוקדם על ידי מערכת החיסון המארחת, הנגיף שומר על רמות מינימליות של ביטוי של האנטיגנים שלו.
הקשר בין ביטוי RV G, אפופטוזיס ופתוגניות
ידוע היטב שזני נגיף כלבת רחוב, שהם פתוגניים משמעותית יותר מזנים המותאמים לתרבית רקמה, מבטאים רמות מוגבלות מאוד של G ואינם גורמים לאפופטוזיס עד מאוחר במחזור הזיהומי, דבר המצביע על כך שהפתוגניות של זן נגיף מסוים נמצאת בקורלציה הפוכה עם ביטוי G של RV ויכולתו לגרום לאפופטוזיס.[ 56 ] ראיות ישירות לקורלציה בין רמת ביטוי G להיקף האפופטוזיס התקבלו עם SPBNGA-GA הרקומביננטי של RV, אשר נשא שני גנים זהים של G וביטא יתר על המידה את G של RV.[ 57 ] מחקרים מורפולוגיים של תרביות נוירונים שנדבקו ב-RV רקומביננטי זה הראו כי תמותת התאים עלתה משמעותית במקביל לביטוי יתר של G של RV וכי אפופטוזיס הוא המנגנון העיקרי המעורב במוות בתיווך G של RV. בפרט, הירידה בצביעת F-actin לאחר זיהום SPBNGA-GA עולה בקנה אחד עם דה-פולימריזציה של סיבי אקטין המושרה על ידי אפופטוזיס. יתר על כן, מספר הגרעינים החיוביים ל-TUNEL בנוירונים נגועים ב-SPBNGA-GA גדל משמעותית בהשוואה לזה שבנוירונים לא נגועים ובנוירונים נגועים ב-SPBNGA. עם זאת, המנגנון שבו גן RV G מתווך את תהליך האיתות האפופטוטי נותר ברובו לא ידוע. הוצע כי ביטוי RV G מעל סף מסוים משבש קשות את קרום התא. סביר מאוד שתאים אפופטוטיים אינם מתנקים במהירות במערכת העצבים המרכזית ולכן עוברים נמק משני. [ 58 ] מצד שני, זיהום RV ובפרט ביטוי יתר של חלבון RV G יכול להוביל לפירופטוזה, מסלול מוות תאי הדומה לאפופטוזיס, שבניגוד לאפופטוזיס, כרוך בהפעלת קספאז 1 ובכך מוביל לנמק. [ 59 ] מידת הנמק או הפירופטוזה הנגרמת על ידי זיהום RV כנראה ממלאת תפקיד קריטי בגרימת חסינות אנטי-ויראלית. בעוד שתאים אפופטוטיים שומרים על שלמות הממברנה שלהם ואינם מגרים את התגובה החיסונית המולדת, תאים נמקיים הופכים לחדירים ומפרישים אדג'ובנטים אנדוגניים שיכולים לעורר תגובה חיסונית מולדת חזקה. [ 60 ]
מאחר שרמת האפופטוזיס/נקרוזיס מתואמת עם אימונוגניות של תאי RV, הוצע כי ההשפעה האימונוסטימולטורית של תאים אפופטוטיים/נקרוטיים תורמת ככל הנראה ליצירת תגובה חיסונית מגנה. לכן, ויסות ביטוי G של RV הוא ככל הנראה גורם חשוב בפתוגנזה של כלבת, מכיוון שהוא מספק אמצעי להישרדות ולהפצה של וריאנטים פתוגניים של RV במערכת העצבים מבלי לגרום נזק נוירוני גלוי ולעורר תגובה חיסונית מגנה שתמנע זיהום.
ביטוי חלבון G מסוג RV עשוי להיות מווסת ברמת סינתזת ה-RNA, ברמה הפוסט-טרנסלציונית, או בשניהם. רמות ה-G מסוג RV המתבטאות על ידי וריאנטים כימריים שונים של RV משתקפות בקצב סינתזת ה-RNA הנגיפי, דבר המצביע על כך שרגולציה דיפרנציאלית של ביטוי חלבון G מסוג RV על ידי וריאנטים אלה נובעת משינויים בקצב שעתוק ה-mRNA הנגיפי. כמו בקצבי שעתוק ה-RNA הנגיפי, כמות ה-G מסוג RV המתבטאת על ידי וריאנטים אלה נמצאת בקורלציה הפוכה עם הפתוגניות הנגיפית. מצד שני, זיהום של תרביות נוירונים ראשוניות עם וריאנט ה-RV הפחות פתוגני CVS-B2c הביא לרמות גבוהות פי ארבעה של חלבון G בהשוואה לזיהום עם וריאנט הפתוגני ביותר CVS-N2c, למרות הסינתזה של רמות דומות של mRNA מסוג G בשני הזיהומים. ניסויי Pulse-chase הראו שרמות חלבון ה-G הגבוהות יותר בנוירונים נגועים ב-CVS-B2c נבעו במידה רבה מקצב פירוק נמוך יותר של חלבון ה-G מסוג CVS-B2c בהשוואה לחלבון ה-G מסוג CVS-N2c. עם זאת, המנגנון המוביל לפירוק פרוטאוליטי מהיר יותר של חלבון ה-G מסוג CVS-N2c נותר להובהר.
תסמינים כַּלֶבֶת
תקופת הדגירה של כלבת היא בממוצע 30-90 ימים. במקרה של זיהום מסיבי דרך פצעים גדולים בראש ובפנים, ניתן לקצר אותה ל-12 ימים. במקרים נדירים, תקופת הדגירה יכולה להימשך שנה או יותר.
יש שינוי רציף לחלוטין של שלוש תקופות של המחלה: פרודרומלי, עירור, שיתוק.
התקופה הפרודרומלית מתחילה עם הופעת כאב או משיכה במקום הנשיכה, כמו גם כאב לאורך העצבים. באזור הצלקת עשויה להיות תחושת צריבה, גירוד, לעיתים אדמומיות ונפיחות. המטופל חווה חולשה כללית, כאב ראש, בחילות. נצפים הקאות, עלייה בטמפרטורת הגוף ל-37.5-38 מעלות צלזיוס ותסמינים של הפרעה נפשית מתקדמת: רגישות רפלקס מוגברת, תחושת חרדה בלתי מוסברת, פחד, מלנכוליה. לעתים קרובות המטופל מדוכא, מעוכב, מסתגר, מסרב לאכול, ישן רע, מתלונן על מחשבות קודרות, חלומות מפחידים. התקופה הפרודרומלית נמשכת 2-3 ימים, לעיתים נמשכת עד 7 ימים. בסוף תקופה זו, ייתכנו התקפי חרדה עם קשיי נשימה לטווח קצר, תחושת לחץ בחזה, מלווה בטכיקרדיה וקצב נשימה מוגבר.
תקופת ההתרגשות מסומנת על ידי הופעת הידרופוביה: כאשר מנסים לשתות, ואז למראה מים או תזכורת להם, המטופל חווה עווית עוויתית של הלוע והגרון, שבמהלכה הוא זורק את ספל המים בצרחה, זורק קדימה ידיים רועדות, זורק את ראשו וגופו לאחור. הצוואר נמתח, עווית כואבת מעוותת את הפנים, שהופכות כחלחלות עקב עווית של שרירי הנשימה. העיניים בולטות, מביעות פחד, מתחננות לעזרה, האישונים מורחבים, השאיפה קשה. בשיא ההתקף, דום לב ונשימה אפשרי. ההתקף נמשך מספר שניות, ולאחר מכן נראה שמצבו של המטופל משתפר. לאחר מכן, התקפי עוויתות של שרירי הגרון והגרון יכולים להתרחש אפילו מתנועת אוויר (איירופוביה), אור בהיר (פוטופוביה) או מילה רועשת (אקוסטיקופוביה). ההתקפים מלווים בתסיסה פסיכומוטורית, שבמהלכה המטופל מתנהג כמו "משוגע". התודעה מעורפלת במהלך ההתקף, אך מתבהרת בתקופה הבין-ריקטלית. במהלך תקופת התסיסה, עקב עלייה בטונוס של מערכת העצבים הסימפתטית, החולים חווים עלייה חדה בהפרשת רוק (סיאלוריאה) עם חוסר יכולת לבלוע רוק עקב עווית של שרירי הלוע. המטופל מרסס רוק. חלק מהחולים עשויים לפתח סימנים של מנינגיזם ואף אופיסטונוס, ועוויתות שכיחות. במקרה זה, נוזל השדרה עשוי שלא להשתנות, אך אצל חלק מהחולים, ריכוז החלבון עשוי לעלות ומספר התאים עשוי לעלות עקב לימפוציטים.
ללא טיפול הולם, סימני התייבשות גוברים, תווי הפנים מתחדדים ומשקל הגוף יורד. טמפרטורת הגוף עולה לערכים גבוהים. עוויתות אפשריות. משך שלב העירור הוא כ-2-3 ימים, לעיתים רחוקות 4-5 ימים. תוצאה קטלנית מתרחשת בדרך כלל במהלך אחת ההתקפים. לעיתים רחוקות, החולה שורד עד לשלב השלישי של המחלה.
במהלך תקופת השיתוק, המטופל נרגע. התקפי ההידרופוביה נפסקים, המטופל יכול לשתות ולבלוע אוכל, התודעה שלו נקייה. עם זאת, למרות הרווחה הנראית לעין, עייפות, אדישות, דיכאון גוברים, שיתוק של הגפיים, הפרעות באגן, שיתוק של עצבי הגולגולת מופיעים במהרה. טמפרטורת הגוף עולה ל-42-43 מעלות צלזיוס, לחץ הדם יורד, ובסוף היום הראשון מתרחש מוות משיתוק של מרכזי הלב וכלי הדם והנשימה.
לויקוציטוזיס נויטרופילי, עלייה ברמות המוגלובין, אריתרוציטים והמטוקריט נצפים בדם ההיקפי.
מה מטריד אותך?
טפסים
מבחינה קלינית מבחינים בין צורות אופייניות לא טיפוסיות. צורות אטיפיות כוללות את כל המקרים ללא עוררות והידרופוביה. צורות אטיפיות כוללות בולבר, צרבלרי, מנינגואנצפליטי וכו'.
אבחון כַּלֶבֶת
גילוי אנטיגן כלבת, נוגדנים, RNA נגיפי או בידוד וירוסים מאפשרים אבחון של כלבת. מכיוון שכל בדיקה בודדת עשויה להיות שלילית אצל חולה עם כלבת, לעיתים נחוצות דגימות סרום סדרתיות לגילוי נוגדנים לכלבת, דגימות רוק לתרבית ויראלית וביופסיה של עור לבדיקת אימונופלואורסצנציה ישירה לאנטיגן ויראלי, במיוחד כאשר קיים חשד כבד לכלבת.
אחת השיטות המהירות ביותר לאבחון כלבת לפני המוות בבני אדם היא ביצוע בדיקת אימונופלואורסצנציה ישירה על ביופסיה של עורף הצוואר כדי לזהות אנטיגן כלבת. בדיקת האימונופלואורסצנציה הישירה היא השיטה הרגישה והספציפית ביותר לגילוי אנטיגן כלבת בעור וברקמות טריות אחרות (למשל, ביופסיה של מוח), אם כי התוצאות עשויות לעיתים להיות שליליות בשלב מוקדם של המחלה. אם רקמה טרייה אינה זמינה, עיכול אנזימטי של רקמות מקובעות עשוי להגביר את הריאקטיביות של בדיקת האימונופלואורסצנציה; עם זאת, הרגישות עשויה להיות נמוכה באופן בלתי מתקבל על הדעת.
ניתן לקבוע את האבחנה גם אם מבודד את הנגיף מרוק לאחר חיסון תאי נוירובלסטומה או מכרסמים במעבדה; זה בדרך כלל יעיל ביותר במהלך 2-3 השבועות הראשונים של המחלה. גילוי נוגדנים מנטרלי נגיף כלבת, המבוצע בדרך כלל על ידי מבחן עיכוב מיקוד פלואורסצנטי מהיר (RFFIT), בסרום של אנשים לא מחוסנים הוא גם אבחון. נוכחות נוגדנים בנוזל השדרה מאשרת את האבחנה, אך הם עשויים להופיע 2-3 ימים מאוחר יותר מנוגדנים בסרום ולכן עשויים להיות פחות שימושיים בשלבים המוקדמים של המחלה. בעוד שהתגובה הסרולוגית לאחר חיסון בדרך כלל אינה ניתנת להבחנה מהתגובה הסרולוגית הנגרמת על ידי המחלה, חיסון בדרך כלל אינו מייצר נוגדנים לנוזל השדרה.
רק שבעה מקרים של "החלמה" מכלבת ב-25 השנים האחרונות תועדו היטב. למרות שלא בודד נגיף הכלבת מאף אחד מהחולים, רמות גבוהות של נוגדנים מנטרלי כלבת בדגימות הסרום ונוכחות נוגדנים מנטרליים בנוזל השדרה תמכו מאוד באבחנה.
מה צריך לבדוק?
אילו בדיקות נדרשות?
אבחון דיפרנציאלי
אבחון כלבת בבני אדם נעשה בדרך כלל על סמך נתונים אפידמיולוגיים וקליניים ומאושר במעבדה. האבחון פשוט אם יש היסטוריה של נשיכות בעלי חיים והספקטרום המלא של התסמינים והסימנים התרחש. אחרת, יש צורך בהערכה מדוקדקת אך מהירה של המאפיינים האפידמיולוגיים והקליניים של מקרים פחות אופייניים לפני ביצוע בדיקות מעבדה ספציפיות. יש לשאול כל חולה עם סימנים או תסמינים נוירולוגיים או דלקת מוח בלתי מוסברת לגבי האפשרות של חשיפה לבעלי חיים באזורים אנדמיים לכלבת בתוך מדינת המגורים או מחוצה לה. ייתכן שכישלון החשד לכלבת במספר מקרי מוות אנושיים אחרונים בארצות הברית נבע מחוסר היסטוריה מדוקדקת של חשיפה.
בתחילת המחלה, כלבת יכולה לחקות מחלות זיהומיות ולא זיהומיות רבות. אנצפליטידים רבים אחרים, כמו אלו הנגרמים על ידי נגיפי הרפס וארבו-וירוסים, דומים לכלבת. מחלות זיהומיות אחרות יכולות גם הן לחקות כלבת, כגון טטנוס, מלריה מוחית, ריקטזיוזיס וטיפוס. מחלות זיהומיות משותקות שניתן לבלבל ביניהן עם כלבת כוללות שיתוק ילדים, בוטוליזם ודלקת מוח הרפס סימיאן B.
מחלות לא זיהומיות שעלולות להתבלבל עם כלבת כוללות מספר תסמונות נוירולוגיות, במיוחד פולינוירופתיה דלקתית חריפה (תסמונת גיליין-בארה), כמו גם דלקת אנצפלומיאליטיס אלרגית לאחר חיסון כתוצאה מחיסון נגד כלבת של רקמת העצבים, הרעלה או שכרות סמים, גמילה מאלכוהול, פורפיריה חריפה והיסטריה של כלבת. תסמונת גיליין-בארה עלולה להתבלבל עם כלבת משותקת, ולהיפך.
למי לפנות?
יַחַס כַּלֶבֶת
טיפול בכלבת לא פותח. מתן מינונים גדולים של אימונוגלובולין ספציפי נגד כלבת ואינטרפרון של לויקוציטים אינו יעיל. טיפול סימפטומטי מנוהל כדי להקל על סבלו של המטופל. לשם כך, המטופל ממוקם במחלקה או בקופסה נפרדת, נוצר משטר מגן המגביל את השפעת הסביבה החיצונית (רעש מופחת, אור בהיר, זרימת אוויר). כדי להפחית את רגישות מערכת העצבים המרכזית, נקבעים כדורי שינה, נוגדי פרכוסים ומשככי כאבים. מאזן המים מנורמל.
בשלב המשותק, נרשמות תרופות המגרות את פעילות מערכות הלב וכלי הדם והנשימה. מומלץ להשתמש בחמצון היפרברי, היפותרמיה מוחית, נשימה מכנית מבוקרת עם קורריזציה מלאה של המטופל. עם זאת, כל שיטות הטיפול כמעט אינן יעילות. במקרה הטוב, ניתן להאריך את חיי המטופל במספר חודשים. תוצאה שלילית נקבעת מראש על ידי חומרת הנזק לגזע המוח עם הרס מרכזים חיוניים.
מְנִיעָה
פיתוח חיסון הכלבת הראשון על ידי פסטר בשנת 1885 בישר עידן של בקרת כלבת יעילה הרבה יותר. כיום, למרות שיעור התמותה של כמעט 100% בבני אדם מכלבת, המחלה ניתנת למניעה מוחלטת באמצעות חיסון לפני ו/או לאחר חשיפה. בעוד שפסטר ועמיתיו יזמו את חיסון הכלבים הפרטיים בפריז, החיסון ההמוני הראשון של כלבים בוצע בתחילת שנות ה-20 ביפן, וסימן את תוכנית בקרת הכלבת הלאומית הגדולה הראשונה. חיסון דרך הפה של חיות בר, שפותח לראשונה בשנות ה-70, הוכח מאז שוב ושוב כמעכב את המחלה ביעילות במארחים יבשתיים עיקריים כמו שועלים, דביבונים ובואשים.[ 68 ] חיסון כלבת מתמשך של אוכלוסיות חיות מאגר בשיעורי כיסוי של 70% או יותר יבטל בסופו של דבר את RABV ממיני מאגר וימנע את התפשטות הנגיף למארחים מזדמנים.[ 69 ]
נתונים פילוגנטיים מצביעים על כך שנגיפי ליסה הדביקו עטלפים הרבה לפני שהדביקו יונקים יבשתיים, ורוב נגיפי הליסה, כולל נגיפי RABV, עדיין מסתובבים במיני עטלפים שונים ברחבי העולם.[ 70 ] עם זאת, שיטות יעילות למניעת העברת נגיפי RABV בקרב עטלפים נותרות חמקמקות, מה שמונעות את האפשרות של מיגור מוחלט של כלבת בשלב זה. עם זאת, גם לאחר חשיפה לנגיף RABV באמצעות נשיכה של יונק נגוע בכלבת, טיפול מונע בטוח ויעיל לאחר חשיפה (PEP, הכולל ניקוי פצעים, גלובולין אימונוגלובולין נגד כלבת וחיסון נגד כלבת) יכול להגן על בני אדם מפני זיהום בכלבת אם הטיפול יינתן במהירות ובהתאם להמלצות ארגון הבריאות העולמי (WHO).
שתי שיטות אלו למניעת מקרי מוות מבני אדם - האחת המבוססת על חיסון אנשים שנחשפו לנגיף והשנייה המבוססת על חיסון מספיק כלבים כדי לשבור את מעגל ההדבקה במקור - הן אבני הבניין של גישת "בריאות אחת" למניעה ובקרה של כלבת בכלבים. שתי שיטות שונות אלו למניעת מקרי מוות מבני אדם נחשבו כחלופות נפרדות: אסטרטגיה א', המבוססת על מתן PEP לבני אדם, ואסטרטגיה ב', המבוססת על חיסון כלבים; או כמרכיבים של אסטרטגיה א' + ב' משולבת בניתוח העלויות הצפויות של האסטרטגיות החלופיות.[ 71 ]
מדינות כמו תאילנד הצליחו רבות במניעת מקרי מוות אנושיים באמצעות שימוש ב-PEP, אך מצאו גם ביקוש גובר ועלויות נלוות הקשורות לשימוש ב-PEP בלבד. [ 72 ] לדוגמה, בהשוואה למצב בשנת 1991, פי ארבעה יותר אנשים (יותר מ-400,000) נזקקו ל-PEP בשנת 2003. נתונים עדכניים מראים כי הרפובליקה העממית של סין, המחסנת 15 מיליון איש בשנה לאחר חשיפה אפשרית לכלבת, מוציאה כ-650 מיליון דולר בשנה על PEP בלבד. [ 73 ]
גישה בת קיימא הרבה יותר היא למנוע את התפשטות הזיהום במקור, באוכלוסיית בעלי החיים, תוך הגברת הגישה לחיסוני חיסון נגד זיהומים (PEP) עבור חולים אנושיים שנחשפו בעת הצורך. במקומות בהם קיים רצון פוליטי ומימון הולם לשליטה בכלבת בכלבים, ניתן היה למנוע את מקרי המוות, וכך גם כן. שימוש נרחב בחיסוני כלבים הוביל לחיסול כלבת בכלבים במספר מדינות, כולל מלזיה בשנת 1954, [ 74 ] יפן בשנת 1956, טייוואן בשנת 1961, סינגפור, ובפרט ברחבי מערב אירופה (נסקר אצל רופרכט ואחרים, קינג ואחרים, וגונגל ורייט). [ 75 ]
Использованная литература


 [
[