המומחה הרפואי של המאמר
פרסומים חדשים
הריון לא מתוכנן באופן קבוע - גורמים
סקירה אחרונה: 04.07.2025

כל תוכן iLive נבדק מבחינה רפואית או נבדק למעשה כדי להבטיח דיוק עובדתי רב ככל האפשר.
יש לנו קווים מנחים קפדניים המקור רק קישור לאתרים מדיה מכובד, מוסדות מחקר אקדמי, בכל עת אפשרי, עמיתים מבחינה רפואית מחקרים. שים לב שהמספרים בסוגריים ([1], [2] וכו ') הם קישורים הניתנים ללחיצה למחקרים אלה.
אם אתה סבור שתוכן כלשהו שלנו אינו מדויק, לא עדכני או מפוקפק אחרת, בחר אותו ולחץ על Ctrl + Enter.
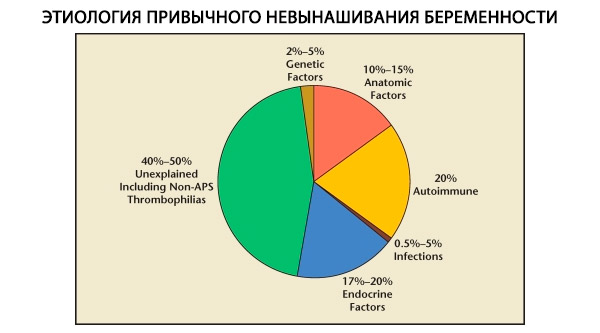
במבנה של אובדן הריון רגיל, נבדלים גורמים גנטיים, אנטומיים, אנדוקריניים, אימונולוגיים וזיהומיים. כאשר כל הסיבות הנ"ל אינן נכללות, נותרת קבוצת חולות שבהן מקור ההפלה הרגילה אינו ברור (הפלות אידיופתיות). על פי C. Coulam ואחרים (1996), 80% מההפלות האידיופתיות מבוססות על הפרעות חיסוניות לא מזוהות.
אין ראיות משכנעות לכך שאנדומטריוזיס גורם להפלות חוזרות, או שטיפול תרופתי או כירורגי באנדומטריוזיס מפחית את שכיחות ההפלות החוזרות.
על פי התפיסות הנוכחיות, בנוסף לגורמים גנטיים וחלקית זיהומיים המובילים להיווצרות עובר לא תקין, יישום ההשפעה המזיקה של גורמים אחרים (אנטומיים, אנדוקריניים, אימונולוגיים) טמון ביצירת רקע שלילי להתפתחות ביצית מופרית שלמה גנטית, מה שמוביל לדלדול קיבולת הרזרבה של הכוריון ולהפסקת ההתפתחות (אמבריוגנזה). תקופות קריטיות בשליש הראשון של ההריון מוכרות כ-6-8 שבועות (מות העובר) ו-10-12 שבועות (פליטת הביצית המופרית).
 [ 1 ]
[ 1 ]
סיבות גנטיות להפלה רגילה
גורמים גנטיים מהווים 3-6% מהגורמים להפלה רגילה. בהפסקות הריון ספורדיות בשליש הראשון, כ-50% מההפלות סובלות ממומים כרומוזומליים. רובם (95%) הם שינויים במספר הכרומוזומים - מונוזומיה (אובדן כרומוזום אחד), טריזומיה (נוכחות כרומוזום נוסף), שהן תוצאה של שגיאות במיוזה, וכן פוליפלואידיה (עלייה בהרכב הכרומוזומים על ידי סט הפלואידי מלא), המתרחשת כאשר ביצית מופרית על ידי שני תאי זרע או יותר. בהפלות ספורדיות, טריזומיה נתקלת לרוב - 60% מכלל המוטציות (לרוב בכרומוזום 16, כמו גם 13, 18, 21, 22), במקום השני בשכיחות נמצאת תסמונת שרשבסקי-טרנר (כרומוזום 45 X0) - 20%, 15% הנותרים אחראים לפוליפלואידיה (במיוחד טריפלואידיה).
במקרה של שינוי במספר הכרומוזומים בהפלה, בדיקת הקריוטיפ של ההורים לרוב אינה מגלה פתולוגיה כלשהי וההסתברות למחלה כרומוזומלית של העובר במהלך הריון עוקב היא 1%. לעומת זאת, בבדיקת הפלות אצל זוגות עם הפלה רגילה, נצפים שינויים מבניים בכרומוזומים (תוך-כרומוזומליים ובין-כרומוזומליים) ב-3-6% מהמקרים. בבדיקת הקריוטיפ של ההורים, נמצאים סידורים כרומוזומליים מאוזנים ב-7% מהמקרים. לרוב, מדובר בטרנסלוקציות הדדיות, שבהן קטע של כרומוזום אחד ממוקם במקום קטע אחר של כרומוזום לא הומולוגי, כמו גם פסיפסיות של כרומוזומי מין, היפוך וגילוי כרומוזומים בצורת טבעת. במקרה של נוכחות של סידורים כאלה אצל אחד מבני הזוג, תהליכי הזיווג וההפרדה של כרומוזומים מעוכבים במהלך המיוזה, מה שמביא לאובדן (מחיקה) או להכפלה (שכפול) של מקטעי כרומוזום בגמטות. כתוצאה מכך, נוצרים סידורים כרומוזומליים לא מאוזנים, שבהם העובר אינו בר-קיימא או משמש כנשא של פתולוגיה כרומוזומלית חמורה. ההסתברות ללדת ילד עם אנומליות כרומוזומליות לא מאוזנות בנוכחות סידורים כרומוזומליים מאוזנים בקריוטיפ של אחד ההורים היא 1-15%. ההבדלים בנתונים קשורים לאופי הסידורים, גודל המקטעים המעורבים, מין הנשא והיסטוריה משפחתית.
אבחון
אנמנזה
- מחלות תורשתיות אצל בני משפחה.
- נוכחות של אנומליות מולדות במשפחה.
- לידת ילדים עם פיגור שכלי.
- נוכחות של אי פוריות ו/או הפלה ממקור לא ידוע אצל זוג נשוי או אצל קרובי משפחה.
- נוכחות מקרים לא ברורים של תמותה פרינטלית.
שיטות מחקר מיוחדות
- מחקר של הקריוטיפ של ההורים מומלץ במיוחד עבור זוגות נשואים בלידת יילוד עם פגמים התפתחותיים בנוסף להיסטוריה של הפלות, כמו גם במקרים של הפלות שגרתיות בשלבים המוקדמים של ההריון.
- ניתוח ציטוגנטי של הפלה במקרים של לידה שקטה או תמותת יילודים.
אינדיקציות להתייעצות עם מומחים אחרים
אם מתגלים שינויים בקריוטיפ אצל ההורים, יש צורך בהתייעצות עם גנטיקאי כדי להעריך את מידת הסיכון ללידת ילד עם פתולוגיה או, במידת הצורך, להחליט על סוגיית תרומת ביצית או זרע.
ניהול נוסף של המטופל
אם לזוג נשוי יש קריוטיפ פתולוגי, אפילו אצל אחד ההורים, מומלץ לבצע אבחון טרום לידתי במהלך ההריון - ביופסיה כוריונית או בדיקת מי שפיר - בשל הסיכון הגבוה להפרעות התפתחותיות בעובר.
סיבות אנטומיות להפלה רגילה
סיבות אנטומיות להפלה רגילה כוללות:
- אנומליות מולדות בהתפתחות הרחם (הכפלה מלאה של הרחם; רחם דו-קרני, רחם בצורת אוכף, רחם חד-קרן; מחיצה תוך רחמית חלקית או מלאה);
- פגמים אנטומיים נרכשים;
- הידבקויות תוך רחמיות (תסמונת אשרמן);
- שרירנים תת-ריריים ברחם;
- אי ספיקה איסתמית-צווארית.
שכיחות האנומליות האנטומיות אצל חולות עם הפלה רגילה נעה בין 10 ל-16%. שכיחות הופעת מומים ברחם שעלולים לגרום להפלה (אך לא לאי פוריות) ביחס לכלל המומים ברחם היא כדלקמן: רחם דו-קרני - 37%, רחם בצורת אוכף - 15%, מחיצה תוך רחמית - 22%, הכפלה מלאה של הרחם - 11%, רחם חד-קרן - 4.4%.
אבחון הפלה רגילה
אנמנזה
במקרה של פתולוגיה אנטומית של הרחם, נצפות לעיתים קרובות הפסקות הריון מאוחרות ולידות מוקדמות, אולם עם השתלה על מחיצת הרחם או ליד הצומת המיומאטית, אפשריות גם הפסקות הריון מוקדמות.
עבור אי ספיקה איסמתמית-צווארית, הסימן הפתוגנומוני הוא הפסקה ספונטנית של הריון בשליש השני או לידה מוקדמת מוקדמת, המתרחשת במהירות יחסית ועם מעט כאב.
במקרה של מומים ברחם, יש לשים לב לאינדיקטורים אנמנסטיים של פתולוגיה של דרכי השתן (לעתים קרובות מלווים אנומליות מולדות של הרחם) ולאופי התפתחות תפקוד הווסת (אינדיקציות להמטומטרה עם קרן ראשונית מתפקדת של הרחם).
שיטות בדיקה מיוחדות
- כיום, היסטרוסלפינגוגרפיה מבוצעת כדי לקבוע אבחנה, המאפשרת לימוד צורת חלל הרחם, זיהוי נוכחות של שרירנים תת-ריריים, הידבקויות, מחיצות צוואר רחם וקביעת פטילות החצוצרות. על מנת לאבחן פתולוגיה של הרחם, רציונלי לבצע היסטרוסלפינגוגרפיה בתקופה שבין הווסת לביוץ, כלומר בשלב הראשון של המחזור החודשי לאחר הפסקת ההפרשה הדמית (יום 7-9 למחזור). כדי לאבחן אי ספיקה איסמתמית-צווארית, המחקר מתבצע בשלב השני של המחזור החודשי (יום 18-20) על מנת לקבוע את מצב מערכת העצבים הפנימית של צוואר הרחם. לפני ביצוע היסטרוסלפינגוגרפיה, יש צורך לשלול מחלות דלקתיות של איברי האגן או לטפל בהן.
- היסטרוסקופיה הפכה נפוצה בשנים האחרונות והפכה לסטנדרט הזהב לאבחון פתולוגיה תוך רחמית. עם זאת, בשל עלותה הגבוהה יותר בהשוואה להיסטרוסלפינגוגרפיה, השיטה משמשת בנשים עם אינדיקציה לפתולוגיה תוך רחמית על סמך נתוני אולטרסאונד ראשוניים. ניתן להשתמש בהיסטרוסקופיה כדי לבדוק את חלל הרחם, לקבוע את אופי הפתולוגיה התוך רחמית, ואם הציוד הדרוש (רסקטוסקופ) זמין, לבצע טיפול כירורגי זעיר פולשני - הסרת הידבקויות, בלוטות מיומה תת-ריריות ופוליפים ברירית הרחם. בעת הסרת מחיצה תוך רחמית, ניתנת עדיפות להיסטרוסקטוסקופיה עם בקרה לפרוסקופית, המונעת את האפשרות של ניקוב דופן הרחם.
- אולטרסאונד מבוצע בשלב הראשון של המחזור החודשי, המאפשר אבחון משוער של מיומה רחמית תת-רירית, הידבקויות תוך רחמיות, ובשלב השני של המחזור - לזיהוי מחיצה תוך רחמית ורחם דו-קרני. לשיטה זו חשיבות מיוחדת בשלבים המוקדמים של ההריון, כאשר הרגישות שלה באבחון מצבים אלה היא 100%, והספציפיות שלה היא 80%. מחוץ להריון, האבחון דורש אישור נוסף בשיטות אחרות.
- מחברים זרים מצביעים על היתרון של סונוהיסטרוגרפיה (אולטרסאונד באמצעות חיישן טרנס-ווגינלי עם החדרה ראשונית של תמיסת נתרן כלורי 0.9% לחלל הרחם) על פני היסטרוסלפינגוגרפיה, שכן היא מאפשרת אבחון דיפרנציאלי בין מחיצת הרחם לרחם דו-קרני. בעזרת סונוהיסטרוגרפיה ניתן לא רק לחקור את צורת חלל הרחם, אלא גם לקבוע את תצורת קרקעית הרחם של גוף הרחם. בארצנו, שיטה זו לא הפכה נפוצה.
- במקרים מורכבים מסוימים, נעשה שימוש ב-MRI של איברי האגן כדי לאמת את האבחנה. השיטה מאפשרת קבלת מידע בעל ערך במקרה של אנומליות התפתחותיות רחמיות המלוות בסידור לא טיפוסי של איברים באגן. MRI חשוב במקרה של קרן רחם ראשונית כדי להחליט האם כדאי להסירה. הצורך להסיר את קרן הרחם הראשונית מתרחש במקרה של חיבורה לחצוצרה ולשחלה כדי למנוע היווצרות והתפתחות של ביצית מופרית בתוכה. הפסקת הריון במקרה של אנומליות אנטומיות של הרחם עשויה להיות קשורה להשתרשות לא מוצלחת של ביצית מופרית (על מחיצה תוך רחמית, ליד קשרית המיומה התת-רירית), כלי דם וקליטה לא מפותחים מספיק של רירית הרחם, יחסים מרחביים קרובים בחלל הרחם (לדוגמה, במקרה של עיוות חלל על ידי קשרית מיומה), לעתים קרובות מלווה ב-ICI, והפרעות הורמונליות.
טיפול בהפלה רגילה
טיפול כירורגי
בנוכחות מחיצה תוך רחמית, בלוטות מיומה תת-ריריות והידבקויות, הטיפול הכירורגי היעיל ביותר הוא באמצעות היסטורוסקטוסקופיה. שכיחות ההפלות הבאות בקבוצת נשים זו לאחר הטיפול היא 10% בהשוואה ל-90% לפני הניתוח. בהשוואת תוצאות המטרופלסטיה שבוצעה באמצעות לפרוטומיה והיסטורוסקטוסקופיה טרנס-צווארית, פ. היינונן (1997) השיגה תוצאות המצביעות על פחות טראומה ויעילות רבה יותר של היסטורוסקטוסקופיה; אחוז ההריונות שהביאו ללידת ילדים ברי קיימא היה 68% ו-86%, בהתאמה.
הסרה כירורגית של מחיצת הרחם, הידבקויות ובלוטות מיומה תת-ריריות מבטלת הפלה ב-70-80% מהמקרים. עם זאת, היא אינה יעילה בנשים עם מומים ברחם שילדו לידות תקינות עם הפלות חוזרות לאחר מכן. סביר להניח שבמקרים כאלה הגורם האנטומי אינו הגורם המוביל, ויש צורך לחפש סיבות אחרות להפלה.
הוכח כי ניתוח מטרופלסטי של הבטן קשור לסיכון משמעותי לאי פוריות לאחר הניתוח ואינו משפר את הפרוגנוזה של הריונות עתידיים. לכן, עדיף לתת עדיפות להיסטרוסקופיה ולניתוחים לפרוסקופיים.
טיפול תרופתי
יעילות הכנסת התקן תוך רחמי, מינונים גבוהים של תרופות אסטרוגניות, הכנסת צנתר פולי לחלל הרחם לאחר ניתוחים להסרת הידבקויות, מחיצה תוך רחמית לא הוכחה. מומלץ לתכנן הריון לא לפני 3 חודשים לאחר הניתוח. כדי לשפר את צמיחת רירית הרחם, מתבצע טיפול הורמונלי מחזורי במשך 3 מחזורי וסת [14]. במשך 3 חודשים ב-14 הימים הראשונים של המחזור, מומלץ ליטול תרופה המכילה 2 מ"ג של 17-בטא-אסטרדיול, ב-14 הימים הבאים - 2 מ"ג של 17-בטא-אסטרדיול ו-20 מ"ג של דידרוגסטרון (10 מ"ג של דידרוגסטרון כחלק מתרופה משולבת בתוספת 10 מ"ג של דידרוגסטרון בצורת טבליות נפרדת).
ניהול נוסף של המטופל
מאפייני מהלך הריון עם רחם דו-קרני או הכפלת הרחם (כאשר ישנם 2 חללי רחם):
- בשלבים המוקדמים של ההריון, דימום מתרחש לעיתים קרובות מהקרן ה"ריקה" או מחלל הרחם עקב תגובה דצידואלית בולטת; הטקטיקות במקרה זה צריכות להיות שמרניות וכוללות שימוש בחומרים נוגדי עוויתות והמוסטטיים;
- איום של הפסקת הריון בשלבים שונים;
- התפתחות של אי ספיקה איסתמית-צווארית;
- עיכוב בגדילה תוך רחמית עקב אי ספיקה שליה.
בשלבים המוקדמים של ההריון, במקרה של דימום, מומלץ מנוחה במיטה ומנוחה חלקית במיטה, כמו גם מתן תרופות המוסטטיות, נוגדות עוויתות והרגעה, וטיפול בפרוגסטרונים (דידרוגסטרון במינון יומי של 20 עד 40 מ"ג) עד שבוע 16-18 להריון.
סיבות אנדוקריניות להפלה רגילה
על פי מחברים שונים, גורמים אנדוקריניים להפלה מהווים 8 עד 20%. המשמעותיים שבהם הם חסר בשלב הלוטאלי (LPD), הפרשת יתר של LH, תפקוד לקוי של בלוטת התריס וסוכרת.
מחלת בלוטת התריס החמורה או סוכרת עלולות להוביל להפלות חוזרות. עם זאת, בסוכרת מפוצה, הסיכון להפלות שגרתיות אינו שונה מזה שבאוכלוסייה הכללית.
במקביל, השכיחות הגבוהה של תת פעילות של בלוטת התריס באוכלוסייה מחייבת ביצוע בדיקות סקר עם מדידת רמות TSH. אצל חולות עם הפלה רגילה, נצפית אי ספיקה של השלב הלוטאלי ב-20-60% מהמקרים, וסימני אולטרסאונד של שחלות פוליציסטיות - ב-44-56%. על פי הספרות, השפעתן של הפרעות הורמונליות אינדיבידואליות על היווצרות קומפלקס התסמינים של הפלה רגילה נותרה שנויה במחלוקת. מחקריהם של מ. אוגסווארה ואחרים (1997) לא גילו הבדלים אמינים בתדירות הפסקת הריון עם ובלי הפסקת הריון לוטאלית אצל חולות עם שתי הפלות קודמות או יותר בהיסטוריה, למעט סיבות אוטואימוניות, אנטומיות וזיהומיות.
אי ספיקה של תפקוד הגופיף הצהוב יכולה להיות תוצאה של מספר גורמים שליליים:
- הפרעות בהפרשת FSH ו-LH בשלב הראשון של המחזור החודשי;
- שיא מוקדם או, להיפך, מאוחר מדי של שחרור LH;
- היפואסטרוגניזם כתוצאה מחוסר פוליקולוגנזה. כל המצבים הללו אינם ניתנים לתיקון על ידי טיפול חלופי בתרופות פרוגסטרון בתקופה שלאחר הביוץ. מחקרים פרוספקטיביים שערכו ל. ריגן ואחרים הראו עלייה משמעותית בתדירות ההפלות אצל חולות עם הפרשת יתר של LH ביום השמיני למחזור החודשי בהשוואה לנשים עם רמות LH תקינות בדם (65% ו-12% מההפלות, בהתאמה). ההשפעה המזיקה של עלייה מוקדמת של LH קשורה לחידוש מוקדם של החלוקה המיוטית השנייה ולביוץ של ביצית לא בשלה, כמו גם לגרימת ייצור אנדרוגנים על ידי תאי תקה יחד עם פגיעה בקליטה של רירית הרחם תחת השפעת אי ספיקה של פרוגסטרון. עם זאת, הפחתה ראשונית של רמות LH טרום-ביוציות באמצעות אגוניסטים של הורמון משחרר גונדוטרופין ללא צעדים נוספים שמטרתם להאריך את ההריון הבא אינה מספקת את ההפחתה הצפויה בתדירות ההפלות.
תקן הזהב לאבחון NLF הוא בדיקה היסטולוגית של חומר המתקבל מביופסיה של רירית הרחם בשלב השני של המחזור במשך 2 מחזורי וסת.
אבחון של סיבות אחרות לתפקוד לקוי של הביוץ, כגון היפרפרולקטינמיה, תת פעילות של בלוטת התריס, עודף תפקודי של אנדרוגנים (שחלות או יותרת הכליה), חייב להיות מלווה במרשם טיפול מתאים.
אבחון
היסטוריה ובדיקה גופנית
- היסטוריה. גורמים שיש לקחת בחשבון: וסת מאוחרת, מחזור חודשי לא סדיר (אוליגומנוריאה, אמנוריאה, עלייה פתאומית במשקל, ירידה במשקל, אי פוריות, הפלות מוקדמות באופן קבוע).
- בדיקה: מבנה גוף, גובה, משקל גוף, שיעור יתר, חומרת מאפיינים מיניים משניים, נוכחות פסים, בדיקת בלוטות חלב לאיתור גלקטוריאה.
- בדיקות אבחון פונקציונליות: מדידת חום רקטלי במהלך 3 מחזורי וסת.
שיטות מחקר מיוחדות
- מחקר הורמונלי:
- בשלב הראשון של המחזור החודשי (יום 7-8) - קביעת תכולת FSH, LH, פרולקטין, TSH, טסטוסטרון, 17-הידרוקסיפרוגסטרון (17-OP), DHEAS;
- בשלב השני של המחזור החודשי (21-22 ימים) - קביעת תכולת פרוגסטרון (המדדים הנורמטיביים של רמות פרוגסטרון משתנים מאוד, לא ניתן להשתמש בשיטה מבלי לקחת בחשבון גורמים אחרים).
- אולטרסאונד:
- בשלב הראשון של המחזור החודשי (יום 5-7) - אבחון פתולוגיה של רירית הרחם, שחלות פוליציסטיות;
- בשלב השני של המחזור החודשי (20-21 ימים) - מדידת עובי רירית הרחם (תקין 10-11 מ"מ, בקורלציה עם תכולת הפרוגסטרון).
- ביופסיה של רירית הרחם לאימות חלון השתן (NLF) מבוצעת יומיים לפני הווסת הצפויה (ביום ה-26 במחזור של 28 יום). שיטה זו משמשת במקרים בהם האבחנה אינה ברורה. כדי לחקור שינויים באנדומטריום בתקופת "חלון ההשרשה", מבוצעת ביופסיה ביום השישי לאחר הביוץ.
יַחַס
כאשר מאבחנים NLF (על פי תרשימי חום רקטליים, משך השלב השני פחות מ-11 ימים, נצפית עלייה הדרגתית בטמפרטורה, טרנספורמציה הפרשית לא מספקת של רירית הרחם על פי נתוני ביופסיה של רירית הרחם, רמות נמוכות של פרוגסטרון בסרום הדם), יש צורך לזהות את הגורם להפרעות כאלה.
אם NLF מלווה בהיפרפרולקטינמיה, מבוצעת MRI של המוח. שיטה חלופית היא צילום רנטגן של הגולגולת (אזור sella turcica).
השלב הראשון בהיפרפרולקטינמיה הוא שלילת אדנומה של בלוטת יותרת המוח, הדורשת טיפול כירורגי. בהיעדר שינויים משמעותיים, היפרפרולקטינמיה נחשבת פונקציונלית, וטיפול בברומוקריפטין נקבע כדי לנרמל את רמות הפרולקטין. המינון ההתחלתי של ברומוקריפטין הוא 1.25 מ"ג ליום למשך שבועיים, לאחר ניטור רמות הפרולקטין, אם האינדיקטורים אינם מתנרמלים, המינון עולה ל-2.5 מ"ג ליום. עם עלייה משמעותית ברמות הפרולקטין, המינון ההתחלתי הוא 2.5 מ"ג ליום. אם מתרחשת הריון, יש להפסיק את הטיפול בברומוקריפטין.
אם מתגלה תת פעילות של בלוטת התריס, אופי הפתולוגיה של בלוטת התריס נקבע יחד עם אנדוקרינולוג. בכל מקרה, מומלץ טיפול יומי בלבותירוקסין נתרן, המינון נבחר באופן אינדיבידואלי עד לרמת נורמליזציה של TSH. אם מתרחש הריון, יש להמשיך את הטיפול בלבותירוקסין נתרן. שאלת כדאיות העלאת המינון בשליש הראשון של ההריון נקבעת יחד עם אנדוקרינולוג לאחר קבלת תוצאות בדיקה הורמונלית (רמת TSH, תירוקסין חופשי).
תיקון NLF מתבצע באחת משתי דרכים. הדרך הראשונה היא גירוי ביוץ, הדרך השנייה היא טיפול חלופי בתכשירי פרוגסטרון.
אפשרות הטיפול הראשונה היא גירוי ביוץ באמצעות קלומיפן ציטרט. שיטת טיפול זו מבוססת על העובדה שרוב הפרעות השלב הלוטאלי מתרחשות בשלב הזקיק של המחזור. רמות פרוגסטרון נמוכות באופן קבוע בשלב השני הן תוצאה של פגיעה בפוליקולוגנזה בשלב הראשון של המחזור. הפרעה זו תתוקן בהצלחה רבה יותר על ידי מינונים נמוכים של קלומיפן ציטרט בשלב הזקיק המוקדם מאשר על ידי מתן פרוגסטרון בשלב השני של המחזור.
במחזור הראשון, מינון הכלומיפן ציטרט הוא 50 מ"ג/יום מהיום החמישי עד התשיעי של המחזור החודשי. היעילות מנוטרת באמצעות תרשימי חום רקטליים, מדידות רמת פרוגסטרון בשלב השני של המחזור, או אולטרסאונד דינמי. אם אין השפעה מספקת במחזור השני של גירוי הביוץ, יש להעלות את מינון הכלומיפן ציטרט ל-100 מ"ג/יום מהיום החמישי עד התשיעי של המחזור. המינון המקסימלי האפשרי במחזור השלישי של גירוי הביוץ הוא 150 מ"ג/יום. עלייה כזו במינון אפשרית רק אם התרופה נסבלת היטב (ללא כאבים עזים בבטן התחתונה ובגב התחתון וללא סימנים אחרים של גירוי יתר שחלתי).
אפשרות הטיפול השנייה: טיפול חלופי בתכשירי פרוגסטרון, המקדמים טרנספורמציה הפרשית מלאה של רירית הרחם, המעניקה את האפקט הדרוש אצל חולות עם הפלה רגילה עם ביוץ שמור. בנוסף, בשנים האחרונות נקבע כי למתן תכשירי פרוגסטרון יש לא רק השפעה הורמונלית, אלא גם השפעה אימונומודולטורית, המדכאת תגובות דחייה של תאים בעלי מערכת חיסון תקינה ברירית הרחם. בפרט, תוארה השפעה דומה עבור דיהידרוגסטרון במינון של 20 מ"ג ליום. לצורך טיפול חלופי, משתמשים בדידרוגסטרון במינון של 20 מ"ג ליום דרך הפה או פרוגסטרון מיקרוניזד בנרתיק במינון של 200 מ"ג ליום. הטיפול מתבצע ביום השני לאחר הביוץ (היום לאחר עליית הטמפרטורה של פי הטבעת) ונמשך 10 ימים. אם מתרחש הריון, יש להמשיך את הטיפול בתכשירי פרוגסטרון.
מחקרים מודרניים לא אישרו את יעילותו של גונדוטרופין כוריוני אנושי בטיפול בהפלות חוזרות.
בהיפר-אנדרוגניזם (ממקור שחלתי או יותרת הכליה) אצל חולות עם הפלה רגילה, טיפול תרופתי מומלץ עקב השפעת האנדרוגנים על שלמות הביוץ ומצב רירית הרחם. במקרה של הפרה של הביוסינתזה של אנדרוגנים של יותרת הכליה, השפעתם המגברית על העובר הנשי אפשרית, לכן טיפול בסטרואידים מתבצע לטובת העובר.
היפר-אנדרוגניזם מגזע שחלתי (שחלות פוליציסטיות)
היסטוריה, בדיקה גופנית ותוצאות בדיקות מיוחדות
- היסטוריה: וסת מאוחרת, הפרעות במחזור החודשי כגון אוליגומנוריאה (בדרך כלל ראשונית, לעתים רחוקות משנית). הריונות נדירים, בדרך כלל מופסקים באופן ספונטני בשליש הראשון, עם תקופות ארוכות של אי פוריות בין ההריונות.
- בדיקה: שיעור יתר, אקנה, סימני מתיחה, מדד מסת גוף גבוה (אופציונלי).
- תרשימי חום רקטליים: מחזורים ללא ביוץ מתחלפים עם מחזורים עם ביוץ ו-NLF.
- בדיקה הורמונלית: רמות טסטוסטרון גבוהות, רמות FSH ו-LH עשויות להיות גבוהות, יחס LH/FSH גדול מ-3. אולטרסאונד: שחלות פוליציסטיות.
יַחַס
טיפול לא תרופתי
ירידה במשקל - דיאטה, פעילות גופנית.
טיפול תרופתי
- אורליסטט במינון של 120 מ"ג עם כל ארוחה עיקרית. משך הטיפול נקבע תוך התחשבות בהשפעה ובסבילות.
- הפחתה ראשונית של טסטוסטרון באמצעות תכשירים המכילים ציפרוטרון אצטט (2 מ"ג) ו-EE (35 מק"ג) למשך 3 מחזורי וסת.
- הפסקת אמצעי מניעה, תמיכה הורמונלית בשלב השני של המחזור (טיפול בפרוגסטרון) - דידרוגסטרון במינון של 20 מ"ג/יום מהיום ה-16 עד ה-25 של המחזור החודשי. אם אין ביוץ ספונטני, יש להמשיך לשלב הבא.
- גירוי ביוץ באמצעות קלומיפן ציטרט במינון התחלתי של 50 מ"ג/יום מהיום החמישי עד ה-9 של המחזור החודשי, עם טיפול בו זמנית בגסטגנים (דידרוגסטרון במינון של 20 מ"ג/יום מהיום ה-16 עד ה-25 של המחזור) ודקסמתזון (0.5 מ"ג).
- בהיעדר הריון, מינון הקלומיפן ציטרט עולה ל-100-150 מ"ג/יום עם מתן פרוסטגנים בשלב השני של המחזור ודקסמתזון (0.5 מ"ג). נקבע כי למרות שדקסמתזון מפחית רק את רמת האנדרוגנים של בלוטת יותרת הכליה, ביוץ והתעברות מתרחשים בתדירות גבוהה משמעותית בטיפול בקלומיפן ציטרט ודקסמתזון מאשר בשימוש בקלומיפן ציטרט בלבד [12].
- מבוצעים שלושה מחזורי גירוי ביוץ, ולאחר מכן מומלצת הפסקה של שלושה מחזורי וסת עם תמיכה גסטגנית והחלטה על טיפול כירורגי באמצעות גישה לפרוסקופית (כריתת טריז של השחלות, אידוי לייזר).
ניהול נוסף של המטופל
ניהול הריון צריך להיות מלווה בתמיכה בהורמון הפרוגסטרון עד שבוע 16 להריון (דידרוגסטרון במינון של 20 מ"ג/יום או פרוגסטרון מיקרוני במינון של 200 מ"ג/יום). דקסמתזון ניתן רק בשליש הראשון של ההריון. ניטור הוא חובה לאבחון בזמן של אי ספיקה איסמטית-צווארית, ובמידת הצורך, תיקונה כירורגי.
היפר-אנדרוגניזם של בלוטת יותרת הכליה (תסמונת אדרנוגניטלית בגיל ההתבגרות ואחריה)
תסמונת אדרנוגניטלית (AGS) היא מחלה תורשתית הקשורה להפרעה בסינתזה של הורמונים בקליפת האדרנל עקב נזק לגנים האחראים על סינתזה של מספר מערכות אנזימים. המחלה עוברת בתורשה באופן אוטוזומלי רצסיבי עם העברת גנים מוטנטים משני ההורים, שהם נשאים בריאים.
ב-90% מהמקרים, תסמונת אדרנוגניטלית נגרמת על ידי מוטציות בגן CYP21B, מה שמוביל לשיבוש בסינתזה של 21-הידרוקסילאז.
היסטוריה, בדיקה גופנית ותוצאות בדיקות מיוחדות
- היסטוריה: וסת מאוחרת, מחזור חודשי מעט מוארך, אוליגומנוריאה אפשרית, הפלות ספונטניות בשליש הראשון, אי פוריות אפשרית.
- בדיקה: אקנה, שיעור יתר, מבנה גוף אנדרואיד (כתפיים רחבות, אגן צר), היפרטרופיה של הדגדגן.
- תרשימי חום רקטליים: מחזורים ללא ביוץ מתחלפים עם מחזורים עם ביוץ ו-NLF.
- בדיקה הורמונלית: רמות גבוהות של 17-OP, DHEAS.
- אולטרסאונד: השחלות לא השתנו.
סימן פתוגומוני מחוץ להריון הוא עלייה בריכוז 17-OP בפלזמת הדם.
כיום, בדיקה עם ACTH משמשת לאבחון הצורה הסמויה, הלא קלאסית, של היפר-אנדרוגניזם של בלוטת יותרת הכליה. לבדיקה זו משתמשים בסינקטן - פוליפפטיד סינתטי בעל תכונות של ACTH אנדוגני, כלומר הוא מגרה את השלבים הראשוניים של סינתזה של הורמוני סטרואידים מכולסטרול בבלוטות יותרת הכליה.
בדיקת סינקטן (אנלוג של ACTH): 1 מ"ל (0.5 מ"ג) של סינקטן מוזרק תת עורית לכתף, התכולה ההתחלתית של 17-OP וקורטיזול נקבעת תחילה בדגימת פלזמה של 9 שעות בבוקר. דגימת דם בקרה נלקחת 9 שעות לאחר ההזרקה כדי לקבוע את רמת 17-OP וקורטיזול. לאחר מכן מחושב מדד הקביעה (D) באמצעות הנוסחה:
D = 0.052 × 17-OP + 0.005 × קורטיזול/17-OP - 0.018 × קורטיזול/17-OP
אם מקדם D קטן או שווה ל-0.069, זה מצביע על היעדר היפר-אנדרוגניזם של בלוטת יותרת הכליה. אם מקדם D גדול מ-0.069, יש לקחת בחשבון שהיפר-אנדרוגניזם נגרם עקב תפקוד לקוי של בלוטות יותרת הכליה.
טיפול תרופתי
הטיפול העיקרי בהיפר-אנדרוגניזם עקב מחסור ב-21-הידרוקסילאז הוא גלוקוקורטיקואידים, המשמשים לדיכוי הפרשת עודפת של אנדרוגן.
ניהול נוסף של המטופל
בשל ההשפעה המגברית של אנדרוגנים אימהיים על העובר, עם אבחנה מבוססת של היפר-אנדרוגניזם של בלוטת יותרת הכליה, טיפול בדקסמתזון במינון התחלתי של 0.25 מ"ג נקבע לפני ההריון ונמשך במינון שנבחר באופן אישי (מ-0.5 עד 1 מ"ג) לאורך כל ההריון. באישה עם הפלה רגילה הסובלת מהיפר-אנדרוגניזם של בלוטת יותרת הכליה, לא ראוי לבטל את הטיפול, מכיוון שתדירות ההפלות בהיעדר טיפול מגיעה ל-14%, עם המשך - 9%.
בהתחשב בעובדה שחולים עם תסמונת אדרנוגניטלית יכולים להעביר גן זה לעובר, יש צורך לבצע אבחון טרום לידתי: בשבוע 17-18 להריון, נקבעת בדיקת דם כדי לקבוע את תכולת ה-17-OP אצל האם. אם רמת ההורמון בדם עולה, נקבע ריכוזו במי השפיר. אם תכולת ה-17-OP במי השפיר עולה, מאובחנת תסמונת אדרנוגניטלית אצל העובר. למרבה הצער, לא ניתן לקבוע את חומרת התסמונת האדרנוגניטלית (צורה קלה או חמורה של בזבוז מלחים) לפי רמת ה-17-OP במי השפיר. שאלת שמירת ההריון במצב זה נקבעת על ידי ההורים.
אם אבי הילד נשא של גן התסמונת האדרנוגניטלית והיו מקרים של ילדים שנולדו עם תסמונת זו במשפחה, אזי החולה, גם ללא היפר-אנדרוגניזם של בלוטת יותרת הכליה, מקבל דקסמתזון לטובת העובר (כדי למנוע ויריליזציה של העובר הנשי) במינון של 20 מק"ג/ק"ג משקל גוף, מקסימום 1.5 מ"ג/יום ב-2-3 מנות לאחר הארוחות. בשבוע 17-18, לאחר קביעת מין העובר וביטוי גן התסמונת האדרנוגניטלית (בהתבסס על תוצאות בדיקת מי שפיר), הטיפול נמשך עד סוף ההריון אם העובר הוא בת עם תסמונת אדרנוגניטלית. אם העובר הוא בן או בת שאינה נשאית של גן התסמונת האדרנוגניטלית, ניתן להפסיק את מתן הדקסמתזון.
אם אישה עם הפלה רגילה סובלת מהיפר-אנדרוגניזם של בלוטת יותרת הכליה, הטיפול בדקסמתזון מתבצע לאורך כל ההריון ומופסק רק לאחר הלידה. ביום השלישי לאחר הלידה, מינון הדקסמתזון מופחת בהדרגה (ב-0.125 מ"ג כל 3 ימים) עד להפסקה מוחלטת בתקופה שלאחר הלידה.
היפר-אנדרוגניזם מגזע מעורב (שחלות ובלתי-אדרנל)
היסטוריה, בדיקה גופנית ותוצאות בדיקות מיוחדות
- היסטוריה: וסת מאוחרת, הפרעות במחזור החודשי כגון אוליגומנוריאה (בדרך כלל ראשונית, לעתים רחוקות משנית), אמנוריאה, פציעות אפשריות, זעזוע מוח. הריונות נדירים, בדרך כלל מופסקים באופן ספונטני בשליש הראשון, תקופות ארוכות של אי פוריות בין הריונות.
- בדיקה גופנית: שיעור יתר, אקנה, סטריאה, אקנתוזיס ניגריקנס, מדד מסת גוף גבוה, יתר לחץ דם.
- תרשימי חום רקטליים: מחזורים ללא ביוץ מתחלפים עם מחזורים עם ביוץ ו-NLF.
- בדיקה הורמונלית: רמות טסטוסטרון גבוהות, רמות FSH ו-LH עשויות להיות מוגברות, יחס LH/FSH גדול מ-3, רמות DHEAS גבוהות, 17-OP, ייתכנו היפרפרולקטינמיה.
- אולטרסאונד: שחלות פוליציסטיות
- אלקטרואנצפלוגרפיה: שינויים בפעילות הביואלקטרית של המוח.
- היפר-אינסולינמיה, הפרעה בחילוף החומרים של שומנים (כולסטרול גבוה, ליפופרוטאינים בצפיפות נמוכה וליפופרוטאינים בצפיפות נמוכה מאוד), ירידה בסבילות לגלוקוז או רמות גלוקוז גבוהות בדם.
יַחַס
טיפול לא תרופתי
ירידה במשקל (דיאטה דלת קלוריות, פעילות גופנית).
טיפול תרופתי
השלב הראשון - בנוכחות עמידות לאינסולין, מומלץ לרשום מטפורמין במינון יומי של 1000-1500 מ"ג כדי להגביר את הרגישות לאינסולין.
השלב השני - במקרה של הפרעות קשות במחזור החודשי ורמות טסטוסטרון גבוהות, מומלץ לרשום תרופות בעלות השפעה אנטי-אנדרוגנית המכילות ציפרוטרון אצטט (2 מ"ג) ואתניל אסטרדיול (35 מק"ג) למשך 3 חודשים.
השלב השלישי הוא גירוי הביוץ ולאחר מכן תמיכה בהתערבות גסטגנית (התוכנית מתוארת לעיל) ונטילת דקסמתזון במינון יומי של 0.25-0.5 מ"ג.
במקרה של היפרפרולקטינמיה והיפותירואידיזם, יש לבצע תיקון תרופתי מתאים במחזורי גירוי ביוץ. אם מתרחשת הריון, יש להפסיק את הטיפול בברומוקריפטין ולהמשיך את הטיפול בלבותירוקסין.
אם גירוי ביוץ אינו יעיל, יש להחליט על שאלת מתן מעוררי ביוץ ישירים, על כדאיות טיפול כירורגי בשחלות פוליציסטיות או על הפריה חוץ גופית.
ניהול נוסף של המטופל
אצל חולות עם תסמונת מטבולית, הריון מסובך לעיתים קרובות על ידי יתר לחץ דם עורקי, נפרופתיה, קרישת דם גבוהה, ובקשר אליהם יש צורך לנטר את לחץ הדם, לבצע בדיקות המוסטאזיוגרמה בשלבים המוקדמים של ההריון ולתקן את ההפרעות המתעוררות (במידת הצורך) באמצעות תרופות להורדת לחץ דם, נוגדי טסיות דם ונוגדי קרישה. תרופות להורדת לחץ דם נקבעות עד שבוע 16 להריון - דידרוגסטרון במינון של 20 מ"ג ליום או פרוגסטרון מיקרוני במינון של 200 מ"ג ליום ב-2 מנות.
כל הנשים עם היפר-אנדרוגניזם מייצגות קבוצת סיכון להתפתחות אי ספיקה איסתמית-צווארית. יש לבצע ניטור של מצב צוואר הרחם החל משבוע 16 להריון, במידת הצורך - תיקון כירורגי של אי ספיקה איסתמית-צווארית.
סיבות אימונולוגיות להפלה רגילה
כיום ידוע שכ-80% מכלל המקרים של אובדן הריון חוזר שלא הוסבר בעבר (לאחר הוצאת סיבות גנטיות, אנטומיות והורמונליות) קשורים להפרעות חיסוניות. מבחינים בין הפרעות אוטואימוניות ואלואימוניות, המובילות להפלה רגילה.
בתהליכים אוטואימוניים, רקמות מערכת החיסון עצמה הופכות למושא לתוקפנות, כלומר התגובה החיסונית מופנית נגד האנטיגנים שלה. במצב זה, העובר סובל באופן משני כתוצאה מנזק לרקמות האם.
בהפרעות אלואימוניות, התגובה החיסונית של האישה מכוונת נגד אנטיגנים עובריים/עובריים שהתקבלו מהאב ושעלול להיות זרים לגוף האם.
הפרעות אוטואימוניות הנפוצות ביותר אצל חולות עם הפלה רגילה כוללות נוכחות של נוגדנים עצמיים אנטי-פוספוליפידים, נוגדנים אנטי-תירואידיים ונוגדי-גרעינים בסרום. לפיכך, נקבע כי 31% מהנשים עם הפלה רגילה מחוץ להריון סובלות מנוגדנים עצמיים לתירוגלובולין ולנוגדן עצמי של בלוטת התריס (נוגדנים עצמיים מיקרוזומליים של בלוטת התריס [תירואיד פראוקסידאז]); במקרים אלה, הסיכון להפלה ספונטנית בשליש הראשון של ההריון עולה ל-20%. בהפלה רגילה, נוכחות של נוגדנים אנטי-גרעיניים ונוגדי-תירואידיים מצביעה על הצורך בבדיקה נוספת כדי לזהות את התהליך האוטואימוני ולאמת את האבחנה.
תסמונת אנטי-פוספוליפידים (APS) נותרה מצב אוטואימוני מוכר בדרך כלל המוביל למוות עובר/עובר.
הפרעות אלואימוניות
כיום, תהליכים אלואימוניים המובילים לדחייה עוברית כוללים נוכחות של מספר מוגבר (יותר מ-3) של אנטיגנים נפוצים של מערכת מורכבות ההיסטוקומפטביליות העיקרית אצל בני זוג (נצפים לעתים קרובות בנישואי קרבת דם); רמות נמוכות של גורמי חסימה בסרום של האם; רמות מוגברות של תאי רוצח טבעיים (תאי NK CD56, CD16) באנדומטריום ובדם ההיקפי של האם הן מחוץ להריון והן במהלך ההריון; רמות גבוהות של ריכוז של מספר ציטוקינים באנדומטריום ובסרום הדם, בפרט, γ-אינטרפרון, גורם נמק הגידול a, אינטרלוקינים-1 ו-2.
כיום, חוקרים גורמים אלואימוניים המובילים לאובדן הריון מוקדם ודרכים לתקן את המצבים הנ"ל. אין הסכמה לגבי שיטות הטיפול. לדברי חלק מהחוקרים, חיסון פעיל עם לימפוציטים מתורמים אינו מייצר השפעה משמעותית, בעוד שמחברים אחרים מתארים השפעה חיובית משמעותית עם חיסון כזה וטיפול באימונוגלובולינים.
כיום, אחד הגורמים האימונומודולטוריים בתחילת ההריון הוא פרוגסטרון. בפרט, מחקרים הוכיחו את תפקידו של דידרוגסטרון במינון יומי של 20 מ"ג אצל נשים עם הפלה רגילה בשליש הראשון של ההריון עם רמה מוגברת של תאי CD56 באנדומטריום.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
תרומבופיליות שנקבעו גנטית
הצורות הבאות של תרומבופיליות שנקבעו גנטית נחשבות למצבים תרומבופיליים במהלך ההריון המובילים להפלה רגילה.
- חוסר באנטיתרומבין III.
- מוטציה של פקטור V (מוטציה בליידן).
- מחסור בחלבון C.
- מחסור בחלבון S.
- מוטציה בגן פרותרומבין G20210A.
- היפר-הומוציסטינמיה.
בדיקה לזיהוי גורמים נדירים לתרומבופיליה נחוצה במקרים בהם היו:
- היסטוריה משפחתית - תרומבואמבוליזם לפני גיל 40 אצל קרובי משפחה;
- אירועים אמינים של טרומבוז ורידי ו/או עורקי לפני גיל 40;
- פקקת חוזרת אצל המטופל ובקרובי משפחה קרובים;
- סיבוכים תרומבואמבוליים במהלך ההריון ואחרי הלידה בעת שימוש באמצעי מניעה הורמונליים;
- אובדן הריון חוזר, לידות מתות, עיכוב בגדילה תוך רחמית, היפרדות שליה;
- רעלת הריון מוקדמת, תסמונת HELLP.
סיבות זיהומיות להפלה רגילה
תפקידו של הגורם הזיהומי כגורם להפלה רגילה נתון כיום לוויכוח נרחב. ידוע כי זיהום ראשוני בשלבים המוקדמים של ההריון עלול לגרום נזק לעובר שאינו תואם את החיים, מה שמוביל להפלה ספונטנית ספוראדית. עם זאת, ההסתברות להפעלה מחדש של הזיהום במקביל להפסדים חוזרים ונשנים של הריון היא זניחה. בנוסף, כיום לא נמצאו מיקרואורגניזמים המעוררים הפלה רגילה. מחקרים בשנים האחרונות הראו כי ברוב הנשים עם הפלה רגילה ודלקת רירית הרחם כרונית יש שכיחות של 2-3 סוגים או יותר של מיקרואורגניזמים ווירוסים אנאירוביים מחייבים באנדומטריום.
על פי VM Sidelnikova ועמיתיו, אצל נשים הסובלות מהפלה רגילה, אבחנה של דלקת רירית הרחם כרונית מחוץ להריון אומתה היסטולוגית ב-73.1% מהמקרים וב-86.7% נצפתה נוכחות של מיקרואורגניזמים אופורטוניסטיים באנדומטריום, דבר שיכול בהחלט להיות הגורם להפעלת תהליכים אימונופתולוגיים. זיהום ויראלי מעורב ועקשן (וירוס הרפס סימפלקס, קוקסאקי A, קוקסאקי B, אנטרווירוסים 68-71, ציטומגלווירוס) נמצא אצל חולות עם הפלה רגילה בתדירות גבוהה משמעותית מאשר אצל נשים עם היסטוריה מיילדת תקינה. K. Kohut ועמיתיו (1997) הראו שאחוז השינויים הדלקתיים באנדומטריום וברקמת הדצידואלה אצל חולות עם הפלה חוזרת ראשונית גבוה משמעותית מאשר אצל נשים לאחר הפלה עם היסטוריה של לידה אחת לפחות במועד.
קולוניזציה חיידקית וויראלית של רירית הרחם נובעת בדרך כלל מחוסר יכולת של מערכת החיסון וכוחות הגנה לא ספציפיים של הגוף (מערכת המשלים, פגוציטוזה) לחסל לחלוטין את הגורם המדבק, ובמקביל, התפשטותו מוגבלת על ידי הפעלת לימפוציטים מסוג T (עוזרים מסוג T, רוצחים טבעיים) ומקרופאגים. בכל המקרים הנ"ל, מתרחשת התמדה של מיקרואורגניזמים, המאופיינת במשיכה של פגוציטים חד-גרעיניים, רוצחים טבעיים, עוזרי T, המסנתזים ציטוקינים שונים, לאתר הדלקת הכרונית. ככל הנראה, מצב כזה של רירית הרחם מונע יצירת דיכוי חיסוני מקומי בתקופה שלפני ההשרשה, הנחוץ ליצירת מחסום מגן ולמניעת דחייה של עובר חצי זר.
בהקשר זה, לפני ההריון, נשים עם הפלה רגילה צריכות להיות מאובחנות עם דלקת רירית הרחם כרונית. כדי לקבוע או לשלול אבחנה זו, מבוצעת ביופסיה של רירית הרחם ביום 7-8 של המחזור החודשי עם בדיקה היסטולוגית, PCR ובדיקה בקטריולוגית של החומר מחלל הרחם. בעת אימות האבחנה, דלקת רירית הרחם כרונית מטופלת על פי הסטנדרטים לטיפול במחלות דלקתיות של איברי האגן.

