המומחה הרפואי של המאמר
פרסומים חדשים
פיברואלסטוזיס
סקירה אחרונה: 05.07.2025

כל תוכן iLive נבדק מבחינה רפואית או נבדק למעשה כדי להבטיח דיוק עובדתי רב ככל האפשר.
יש לנו קווים מנחים קפדניים המקור רק קישור לאתרים מדיה מכובד, מוסדות מחקר אקדמי, בכל עת אפשרי, עמיתים מבחינה רפואית מחקרים. שים לב שהמספרים בסוגריים ([1], [2] וכו ') הם קישורים הניתנים ללחיצה למחקרים אלה.
אם אתה סבור שתוכן כלשהו שלנו אינו מדויק, לא עדכני או מפוקפק אחרת, בחר אותו ולחץ על Ctrl + Enter.
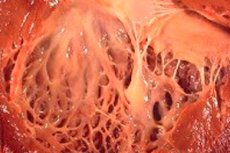
ברפואה, המונח "פיברואלסטוזיס" מתייחס לשינויים ברקמת החיבור של הגוף המכסה את פני האיברים הפנימיים וכלי הדם הנגרמים כתוצאה משיבוש בגדילת הסיבים האלסטיים. במקביל, נצפית עיבוי של דפנות האיברים והמבנים שלהם, דבר המשפיע בהכרח על תפקודן של מערכות חיוניות בגוף, ובפרט על מערכות הלב וכלי הדם והנשימה. דבר זה כרוך בתורו בהידרדרות ברווחתו של המטופל, במיוחד במהלך מאמץ גופני, המשפיעה על איכות ומשך החיים.
אֶפִּידֶמִיוֹלוֹגִיָה
באופן כללי, מחלות המלוות בשינויים ברקמת החיבור, וכתוצאה מכך עיבוי הקרומים והמחיצות של איברים פנימיים, ניתנות לחלוקה לשתי קבוצות: פיברואלסטוזיס לבבי ופיברואלסטוזיס ריאתי. פתולוגיה של הלב יכולה להיות מולדת ונרכשת; בצורה הריאתית של המחלה, אנו מדברים על מחלה נרכשת.
פיברואלסטוזיס ריאתי מתחיל להתפתח בגיל העמידה (קרוב יותר לגיל 55-57), אם כי במחצית מהמקרים יש לחפש את מקור המחלה בילדות. תקופה "קלה" אופיינית, כאשר תסמיני המחלה נעדרים. יחד עם זאת, למחלה אין העדפות מגדריות ויכולה להשפיע באותה מידה על נשים וגברים כאחד. פתולוגיה נדירה למדי זו מאופיינת בשינויים ברקמות הפלאורה והפרנכימה (תאים פונקציונליים) של הריאה, בעיקר באונה העליונה של הריאה. מכיוון שהאטיולוגיה והפתוגנזה של המחלה נותרות לא ברורות, המחלה מסווגת כפתולוגיה אידיופטית. על פי המינוח הרפואי, היא נקראת "פיברואלסטוזיס פליופרופרקינכימטית". [ 1 ]
פיברואלסטוזיס לבבי הוא שם כללי לפתולוגיה של קרומי הלב, המאופיינת בעיבוי ובתפקוד מופחת שלהן. צורות מולדות של הפתולוגיה מאופיינות בעיבוי מפושט (נרחב) של הקרום הפנימי של הלב. זוהי רקמת חיבור דקה המצפת את חלל הלב (מקטעיו) ויוצרת את המסתמים שלו.
אצל חולים בוגרים, בדרך כלל מאובחנת צורה מוקדית של המחלה, כאשר נראה כי המשטח הפנימי של הלב מכוסה בכתמים של רקמה חזקה ועבה יותר (הוא עשוי לכלול לא רק סיבים גדלים יתר על המידה, אלא גם מסות טרומבוטיות).
במחצית מהמקרים של פיברואלסטוזיס לבבי, לא רק דופן האיבר מתעבה, אלא גם המסתמים (מיטרלי דו-צניפי בין העלייה לחדר בעל אותו שם, אבי העורקים הטרי-צניפי בין החדר השמאלי לאבי העורקים, ריאתי בין החדר הימני לעורק הריאה). דבר זה בתורו יכול לשבש את תפקוד המסתמים ולגרום להיצרות פתח העורק, שהוא ממילא קטן בהשוואה לחללים אחרים בלב.
בטרמינולוגיה רפואית, פיברואלסטוזיס אנדוקרדיאלית נקרא פיברואלסטוזיס אנדוקרדיאלית (פיברואלסטוזיס טרום לידתי, טרשת אנדוקרדיאלית, אנדוקרדיטיס עוברית וכו'). אך לעתים קרובות למדי, גם השכבה השרירית האמצעית של קרום הלב יכולה להיות מעורבת בתהליך. [ 2 ]
אנומליות במבנה שריר הלב (השכבה השרירית של הלב, המורכבת מקרדיומיוציטים), מוטציות גנטיות ותהליכים זיהומיים חמורים יכולים לגרום לצורה נפוצה של פיברואלסטוזיס, כאשר לא רק האנדוקרד אלא גם שריר הלב מעורבים בתהליך. בדרך כלל, תהליכים דיספלסטיים באנדוקרד, הנגרמים מסיבות שונות, מתרחשים בגבול המגע שלו עם קרום השרירים, ומשבשים את התכווצות שכבה זו. במקרים מסוימים, יש אף צמיחה של השכבה הפנימית לתוך שריר הלב, החלפת קרדיומיוציטים בפיברובלסטים וסיבים, מה שמשפיע על מוליכות הדחפים העצביים ועל העבודה הקצבית של הלב.
דחיסת כלי הדם בעובי קרום הלב על ידי שריר הלב המעובה משבשת את תזונת שריר הלב (איסכמיה שריר הלב), מה שבתורו יכול להוביל לנמק של רקמות שריר הלב.
פיברואלסטוזיס אנדוקרדיאלית עם נזק לשריר הלב נקרא פיברואלסטוזיס תת-אנדוקרדיאלית או אנדומיוקרדיאלית.
על פי הסטטיסטיקה, ברוב המקרים של מחלה נדירה זו (רק 0.007% מכלל הילודים), מאובחנת פיברואלסטוזיס של החדר השמאלי של הלב, אם כי במקרים מסוימים התהליך מתפשט גם לחדר הימני ולפרוזדורים, כולל השסתומים המפרידים ביניהם.
פיברואלסטוזיס לבבי מלווה לעיתים קרובות בנזק לכלי דם כליליים גדולים, המכוסים גם הם ברקמת חיבור. בבגרות, זה קורה לעיתים קרובות על רקע טרשת עורקים מתקדמת בכלי הדם.
המחלה נרשמת לרוב במדינות אפריקאיות טרופיות בקרב אוכלוסיות בעלות רמת חיים נמוכה, הנובעת מתזונה לקויה, זיהומים תכופים ומזונות וצמחים מסוימים הנצרכים כמזון.
עיבוי אנדוקרדיאלי נצפה גם בשלב האחרון של אנדוקרדיטיס פיברופלסטית ע"ש לופלר, אשר משפיעה בעיקר על גברים בגיל העמידה. הפתוגנזה של מחלה זו קשורה גם לגורמים זיהומיים הגורמים להתפתחות אאוזינופיליה חמורה, האופיינית יותר לזיהומים טפיליים פנימיים. במקרה זה, רקמות הגוף (בעיקר שריר הלב והמוח) מתחילות לחוות חוסר חמצן (היפוקסיה). למרות הדמיון בין תסמיני פיברואלסטוזיס לבבי ואנדוקרדיטיס פיברו ע"ש לופלר, רופאים רואים בהן מחלות שונות לחלוטין.
גורם ל פיברואלסטוזיס
פיברואלסטוזיס מתייחס לשינויים ברקמת החיבור באיברים חיוניים: הלב והריאות, המלווים בהפרעה בתפקוד האיברים ומתבטאים במראה ובמצב החולה. רופאים מכירים את המחלה כבר עשרות שנים. פיברואלסטוזיס של הציפוי הפנימי של הלב (אנדוקרדיום) תוארה עוד בתחילת המאה ה-18, ושינויים דומים בריאות החלו להידון כמאתיים וחצי מאוחר יותר. עם זאת, הרופאים טרם הגיעו להסכמה סופית לגבי הגורמים להתרבות הפתולוגית של רקמת החיבור.
עדיין לא ברור מה בדיוק גורם להפרעה בגדילה ובהתפתחות של סיבי חיבור. אך מדענים מזהים גורמי סיכון מסוימים לשינויים כאלה, ורואים בהם גורמים אפשריים (אך לא סופיים) למחלה.
לפיכך, בפתוגנזה של פיברואלסטוזיס ריאתי, הנחשבת למחלה של אנשים בוגרים, ניתן תפקיד מיוחד לנגעים זיהומיים חוזרים ונשנים של האיבר, הנמצאים במחצית מהחולים. זיהומים מעוררים דלקת של רקמת הריאה והפלאורה, ודלקת ארוכת טווח גורמת לשינוי הסיבים שלהם.
לחלק מהחולים יש היסטוריה משפחתית של פיברואלסטוזיס, דבר המצביע על נטייה תורשתית. נוגדנים עצמיים לא ספציפיים נמצאו בגופם, אשר מעוררים תהליכים דלקתיים ארוכי טווח בעלי אטיולוגיה לא ודאית.
קיימת דעה כי שינויים סיביים ברקמת הריאה יכולים להיגרם על ידי מחלת ריפלוקס קיבתי-ושטי. אם כי קשר זה הוא ככל הנראה עקיף. כמו כן, מאמינים כי הסיכון לפיברואלסטוזיס גבוה יותר בקרב אלו הסובלים ממחלות לב וכלי דם או טרומבוז ריאתי.
פיברואלסטוזיס ריאתי בגיל צעיר ובגיל ההתבגרות עשוי להזכיר את עצמו במהלך ההריון. בדרך כלל המחלה מוסתרת כ-10 שנים או יותר, אך היא עשויה להתבטא מוקדם יותר, אולי עקב עומס מוגבר על גוף האם ההרה ושינויים הורמונליים, אך עדיין אין הסבר מדויק. עם זאת, תמונה דומה של התפתחות המחלה נצפתה ב-30% מהמטופלות שנבדקו בגיל הפוריות.
הריון כשלעצמו אינו יכול לגרום למחלה, אך הוא יכול להאיץ את התפתחות האירועים, וזה עצוב מאוד, משום ששיעור התמותה מהמחלה גבוה מאוד, ותוחלת החיים עם פיברואלסטוזיס קצרה.
ברוב המקרים, ניתן לייחס פיברואלסטוזיס לבבי למחלות ילדות. פתולוגיה מולדת מתגלה בתקופה הטרום לידתית אצל עובר בן 4-7 חודשים, אך ניתן לאשר את האבחנה רק לאחר לידת הילד. מספר גורמים שליליים אפשריים נלקחים בחשבון בפתוגנזה של צורה זו של המחלה: מחלות זיהומיות ודלקתיות של האם המועברות לעובר, חריגות בהתפתחות קרומי הלב, אספקת דם לקויה לרקמת הלב, מוטציות גנטיות, מחסור בחמצן.
מאמינים כי מבין זיהומים, וירוסים תורמים את התרומה הפתוגנית הגדולה ביותר להתפתחות פיברואלסטוזיס לבבי, משום שהם משובצים בתאי הגוף, הורסים אותם ומשנים את תכונות הרקמות. מערכת החיסון הלא מפותחת של העובר אינה יכולה לספק לו הגנה מפני פתוגנים אלה, בניגוד לחסינותה של האם ההרה. האחרונה עשויה שלא לחוות את השלכות הזיהום הנגיף, בעוד שאצל העובר, זיהום תוך רחמי יכול לעורר את הופעתן של אנומליות שונות.
ישנם מדענים המאמינים כי התפקיד המכריע בפתוגנזה של הצורה הזיהומית של פיברואלסטוזיס ממלא זיהום המשפיע על העובר עד גיל 7 חודשים. בהמשך, הוא יכול לגרום רק למחלות דלקתיות של הלב (מיוקרדיטיס, אנדוקרדיטיס).
אנומליות בהתפתחות הקרומים והשסתומים של הלב יכולות להיגרם הן על ידי תהליך דלקתי והן על ידי תגובות אוטואימוניות לא מספקות, וכתוצאה מכך תאי מערכת החיסון מתחילים לתקוף את תאי הגוף עצמו.
מוטציות גנטיות גורמות להתפתחות לא תקינה של רקמת חיבור, משום שגנים מכילים מידע על המבנה וההתנהגות של מבני חלבונים (בפרט, חלבוני קולגן ואלסטין).
היפוקסיה ואיסכמיה של רקמת הלב עשויות להיות תוצאה של התפתחות לב לא תקינה. במקרה זה, אנו מדברים על פיברואלסטוזיס משני, הנגרם על ידי מומי לב מולדים (CHD). אלה כוללות אנומליות הגורמות לחסימה (פגיעה בפתילות הלב וכלי הדם):
- היצרות או היצרות של אבי העורקים ליד המסתם,
- היצרות או היצרות מקטעית של אבי העורקים בצומת הקשת והחלק היורד שלה,
- אטרזיה או היעדר פתח טבעי באבי העורקים,
- תת-התפתחות של רקמת הלב (לרוב החדר השמאלי, לעתים רחוקות החדר הימני והפרוזדורים), המשפיעה על תפקוד השאיבה של הלב.
ישנה דעה כי רעילות במהלך ההריון יכולה גם לשמש כגורם סיכון לפיברואלסטוזיס אצל העובר.
בתקופה שלאחר הלידה, התפתחות פיברואלסטוזיס לבבי יכולה להיות מסייעת על ידי מחלות זיהומיות ודלקתיות של קרומי האיברים, הפרעות המודינמיות כתוצאה מפציעות, תרומבואמבוליזם בכלי דם, דימום בשריר הלב, הפרעות מטבוליות (יצירת פיברין מוגברת, הפרעות מטבוליזם של חלבונים וברזל: עמילואידוזיס, המוכרומטוזיס). אותן סיבות גורמות להתפתחות המחלה אצל מבוגרים.
פתוגנזה
רקמת חיבור היא רקמה מיוחדת בגוף האדם, שהיא חלק כמעט מכל האיברים, אך אינה משתתפת באופן פעיל בתפקודם. לרקמת החיבור מיוחסות פונקציות תומכות ומגנות. היא יוצרת מעין שלד (מסגרת, סטרומה) ומגבילה את התאים התפקודיים של האיבר, ומבטיחה את צורתו וגודלו הסופיים. בעלת חוזק מספיק, רקמת החיבור מגנה גם על תאי האיבר מפני הרס ופגיעה, מונעת חדירת פתוגנים, ובעזרת תאי מקרופאג' מיוחדים סופגת מבנים מיושנים: תאי רקמה מתים, חלבונים זרים, רכיבי דם פסולת וכו'.
ניתן לכנות רקמה זו עזר, משום שאינה מכילה אלמנטים תאיים המבטיחים את התפקוד של איבר זה או אחר. עם זאת, תפקידה בחיי הגוף גדול למדי. בהיותה חלק מקרומי כלי הדם, רקמת החיבור מבטיחה את הבטיחות והתפקוד של מבנים אלה, שבזכותם מתבצעות הזנה ונשימה (טרופיזם) של הרקמות הסובבות את הסביבה הפנימית של הגוף.
ישנם מספר סוגים של רקמת חיבור. הקרום המכסה את האיברים הפנימיים נקרא רקמת חיבור רופפת. זהו חומר נוזלי למחצה וחסר צבע המכיל סיבי קולגן גליים וסיבים אלסטין ישרים, שביניהם מפוזרים באופן אקראי סוגים שונים של תאים. חלק מתאים אלה (פיברובלסטים) אחראים על היווצרות מבנים סיביים, אחרים (אנדותליוציטים ותאי מאסט) יוצרים מטריצה שקופה של רקמת חיבור ומייצרים חומרים מיוחדים (הפרין, היסטמין), אחרים (מקרופאגים) מספקים פגוציטוזה וכו'.
הסוג השני של רקמה סיבית הוא רקמת חיבור צפופה, שאינה מכילה מספר רב של תאים בודדים, אשר בתורה מחולקת ללבנה וצהובה. הרקמה הלבנה מורכבת מסיבי קולגן ארוזים היטב (רצועות, גידים, קרום העצם), והרקמה הצהובה מורכבת מסיבי אלסטין שלובים זה בזה באופן כאוטי עם תכלילים של פיברובלסטים (חלק מהרצועות, קרומי כלי הדם, הריאות).
רקמות חיבור כוללות גם: דם, שומן, עצם וסחוס, אך איננו מתעניינים בהן עדיין, שכן, כשמדברים על פיברואלסטוזיס, אנו מתכוונים לשינויים במבנים סיביים. וסיבים אלסטיים וגמישים נמצאים רק ברקמות חיבור רופפות וצפופות.
הסינתזה של פיברובלסטים ויצירת סיבי רקמת חיבור מהם מווסתים ברמת המוח. זה מבטיח את קביעות מאפייניה (חוזק, גמישות, עובי). אם, עקב סיבות פתולוגיות כלשהן, הסינתזה וההתפתחות של רקמות עזר מופרעות (מספר הפיברובלסטים עולה, "התנהגותם" משתנה), ישנה התפשטות של סיבי קולגן חזקים או שינוי בגדילתם של סיבי קולגן אלסטיים (הם נשארים קצרים, מתפתלים), מה שמוביל לשינוי בתכונות קרום האיבר ובמבנים פנימיים מסוימים המכוסים ברקמת חיבור. הם רוכשים עובי גדול מהנדרש, הופכים צפופים יותר, חזקים יותר ולא אלסטיים, דומים לרקמה סיבית ברצועות ובגידים, מה שדורש מאמץ רב כדי למתוח.
רקמה כזו אינה נמתחת היטב, מה שמגביל את תנועות האיבר (תנועות אוטומטיות קצביות של הלב וכלי הדם, שינויים בגודל הריאות בזמן שאיפה ונשיפה), ומכאן הפרעה באספקת הדם ובאיברי הנשימה, מה שמוביל למחסור בחמצן.
העובדה היא שאספקת הדם לגוף מתבצעת הודות ללב, הפועל כמשאבה, ולשני מעגלי מחזור דם. מחזור הדם הריאתי אחראי על אספקת הדם וחילוף הגזים בריאות, משם חמצן מועבר ללב עם זרימת הדם, ומשם למחזור הדם הסיסטמי ומפוזר בכל הגוף, ומספק נשימה לאיברים ולרקמות.
הממברנה האלסטית, המגבילה את התכווצות שריר הלב, מפחיתה את תפקוד הלב, שאינו שואב דם באותה אקטיביות, ואיתו חמצן. עם פיברואלסטוזיס של הריאות, האוורור שלהן (אוזיגנציה) נפגע, ברור שפחות חמצן מתחיל להיכנס לדם, מה שגם עם תפקוד לב תקין, יתרום למחסור בחמצן (היפוקסיה) של רקמות ואיברים. [ 3 ]
תסמינים פיברואלסטוזיס
פיברואלסטוזיס לבבי וריאתי הן שני סוגים של מחלות המאופיינות בהפרעה בסינתזת סיבים ברקמת החיבור. יש להן מיקומים שונים, אך שתיהן עלולות לסכן חיים, מכיוון שהן קשורות לאי ספיקת לב ונשימה מתקדמת או חמורה.
פיברואלסטוזיס ריאתי הוא סוג נדיר של מחלה אינטרסטיציאלית של איבר חשוב זה במערכת הנשימה. אלה כוללים פתולוגיות כרוניות של פרנכימת הריאה עם נזק לדפנות האלוואולריות (דלקת, שיבוש המבנה והמבנה שלהן), הציפוי הפנימי של נימים ריאתיים וכו'. פיברואלסטוזיס נחשבת לעתים קרובות לצורה נדירה במיוחד של דלקת ריאות מתקדמת עם נטייה לשינויים סיביים ברקמות הריאה והפלאורה.
כמעט בלתי אפשרי לזהות את המחלה ממש בהתחלה, משום שהיא עלולה לא להזכיר את עצמה במשך כ-10 שנים. תקופה זו נקראת מרווח זמן ברור. ניתן לזהות במקרה את תחילתם של שינויים פתולוגיים שעדיין אינם משפיעים על נפח הריאות וחילוף הגזים, במהלך בדיקה מפורטת של הריאות בקשר למחלה אחרת של מערכת הנשימה או פציעה.
המחלה מאופיינת בהתקדמות איטית של תסמינים, כך שהביטויים הראשונים של המחלה יכולים להתעכב משמעותית בזמן מהופעתה. התסמינים מתעצמים בהדרגה.
הסימנים הראשונים של המחלה שכדאי לשים לב אליהם הם שיעול וקוצר נשימה גובר. תסמינים כאלה הופכים לעתים קרובות לתוצאה של מחלת נשימה קודמת, ולכן הם יכולים להיות קשורים להצטננות ולהשלכותיה לאורך זמן. קוצר נשימה נתפס לעתים קרובות כהפרעה לבבית או שינויים הקשורים לגיל. אחרי הכל, המחלה מאובחנת אצל אנשים המתקרבים לגיל מבוגר.
טעויות יכולות להתרחש הן על ידי מטופלים והן על ידי רופאים הבודקים אותם, מה שמוביל לגילוי מאוחר של מחלה מסוכנת. כדאי לשים לב לשיעול, שאינו פרודוקטיבי בפיברולסטוזיס, אך אינו מגורה על ידי תרופות מוקוליטיות ומכייחות, אלא נעצר על ידי תרופות נוגדות שיעול. שיעול ממושך מסוג זה הוא סימפטום אופייני לפיברולסטוזיס ריאתי.
קוצר נשימה נגרם כתוצאה מאי ספיקת נשימה מתקדמת עקב עיבוי דפנות האלוואולריות והפלאורה, ירידה בנפח ובמספר חללי האלוואולריות בריאה (הפרנכימה של האיבר נראית בצילום רנטגן כחלת דבש). התסמין מתעצם תחת השפעת מאמץ פיזי, תחילה משמעותי, ולאחר מכן אפילו קטן. ככל שהמחלה מתקדמת, היא מחמירה, מה שגורם לנכות ולמוות של המטופל.
התקדמות הפיברואלסטוזיס מלווה בהידרדרות במצב הכללי: היפוקסיה מובילה לחולשה וסחרחורת, משקל הגוף יורד (אנורקסיה מתפתחת), פלנגות הציפורניים משתנות לסוג של מקלות תוף, העור הופך חיוור ובעל מראה חולני.
מחצית מהחולים מפתחים תסמינים לא ספציפיים כגון קשיי נשימה וכאבים בחזה, האופייניים לפנאומוטורקס (הצטברות גזים בחלל הצדר). אנומליה זו יכולה להתרחש גם כתוצאה מפציעות, מחלות ריאה ראשוניות ומשניות, טיפול לא נכון, ולכן לא ניתן לאבחן אותה.
פיברואלסטוזיס לבבי, כמו גם הפתולוגיה של צמיחת רקמת חיבור בריאות, מאופיינת ב: עור חיוור, ירידה במשקל, חולשה, שלעתים קרובות התקפית, קוצר נשימה. ייתכנו גם טמפרטורה תת-חומית מתמשכת ללא סימני הצטננות או זיהום.
חולים רבים חווים שינויים בגודל הכבד. הכבד גדל ללא תסמינים של תפקוד לקוי. נפיחות ברגליים, בפנים, בזרועות ובאזור העצה אפשרית גם כן.
ביטוי אופייני למחלה נחשב לאי ספיקת דם גוברת הקשורה להפרעה בתפקוד הלב. במקרה זה, מאובחנת טכיקרדיה (קצב לב מוגבר, לעיתים קרובות בשילוב עם הפרעות קצב), קוצר נשימה (כולל בהיעדר פעילות גופנית), ציאנוזיס של רקמות (צבע כחלחל הנגרם מהצטברות של קרבוקסיהמוגלובין בדם, כלומר תרכובת של המוגלובין עם פחמן דו-חמצני עקב הפרעה בזרימת הדם, ובהתאם חילוף גזים).
במקרה זה, התסמינים עשויים להופיע מיד לאחר לידתו של ילד עם פתולוגיה זו, או לאורך זמן. כאשר ילדים גדולים יותר ומבוגרים מושפעים, סימנים של אי ספיקת לב חמורה מופיעים בדרך כלל על רקע זיהום בדרכי הנשימה, אשר משמש כטריגר. [ 4 ]
פיברואלסטוזיס אצל ילדים
אם פיברואלסטוזיס ריאתי היא מחלה של מבוגרים, שמקורה לעתים קרובות בילדות, אך אינה מתבטאת זמן רב, אזי פתולוגיה דומה של האנדוקרדיום של הלב מופיעה לעתים קרובות עוד לפני לידת התינוק ומשפיעה על חייו מהרגעים הראשונים של הלידה. פתולוגיה נדירה אך חמורה זו היא הגורם להתפתחות אי ספיקת לב קשה לתיקון אצל תינוקות, שרבים מהם מתים תוך שנתיים. [ 5 ]
פיברואלסטוזיס אנדוקרדיאלית אצל יילודים היא ברוב המקרים תוצאה של תהליכים פתולוגיים המתרחשים בגוף התינוק במהלך גיל הטרום לידתי. זיהומים המתקבלים מהאם, מוטציות גנטיות, חריגות בהתפתחות מערכת הלב וכלי הדם, מחלות מטבוליות תורשתיות - כל זה, על פי מדענים, יכול להוביל לשינויים ברקמת החיבור בקרום הלב. במיוחד אם עובר בן 4-7 חודשים נחשף לשני גורמים או יותר בו זמנית.
לדוגמה, שילוב של חריגות בהתפתחות הלב וכלי הדם הכליליים (היצרות, אטרזיה, היצרות אבי העורקים, התפתחות חריגה של תאי שריר הלב, חולשה אנדוקרדיאלית וכו'), התורמות לאיסכמיה של רקמות, בשילוב עם תהליך דלקתי עקב זיהום, משאיר את הילד כמעט ללא סיכוי להישרדות. בעוד שפגמים בהתפתחות האיברים עדיין ניתנים לתיקון מהיר, פיברואלסטוזיס מתקדמת ניתנת רק להאטה, אך לא לריפוי.
בדרך כלל, פיברואלסטוזיס לבבי אצל העובר מתגלה כבר במהלך ההריון במהלך אבחון אולטרסאונד בשליש השני או השלישי. אולטרסאונד ואקו לב בשבוע 20 עד 38 הראו היפר-אקוגניות, דבר המצביע על עיבוי ודחיסה של האנדוקרדיום (בדרך כלל מפושט, לעתים רחוקות יותר מוקדי), שינוי בגודל ובצורת הלב (האיבר מורחב ולובש צורה של כדור או קליע, המבנים הפנימיים מוחלקים בהדרגה). [ 6 ]
ב-30-35% מהמקרים, פיברואלסטוזיס זוהתה לפני שבוע 26 להריון, ב-65-70% - בתקופה שלאחר מכן. ביותר מ-80% מהילודים, פיברואלסטוזיס משולב עם מומי לב חסימתיים, כלומר הוא משני, למרות השלבים המוקדמים של גילויו. היפרפלזיה של חדר שמאל זוהתה במחצית מהילדים שנפגעו, מה שמסביר את השכיחות הגבוהה של פיברואלסטוזיס במבנה לב ספציפי זה. פתולוגיות של אבי העורקים והמסתם שלו, שנמצאו בשליש מהילדים עם ריבוי אנדוקרדיאלי, מובילות גם לעלייה (התרחבות) של תא החדר השמאלי ולשיבוש תפקודו.
במקרה של פיברואלסטוזיס לבבי שאושר באופן אינסטרומנטלי, רופאים ממליצים על הפסקת הריון. כמעט בכל הילדים שנולדו שאמותיהם סירבו להפלה תרופתית, סימני המחלה אושרו. תסמיני אי ספיקת לב, האופייניים לפיברואלסטוזיס, מופיעים תוך שנה (לעיתים רחוקות בשנה השנייה-שלישית לחיים). אצל ילדים עם צורה משולבת של המחלה, סימני אי ספיקת לב מתגלים כבר בימים הראשונים לחיים.
צורות מולדות של פיברואלסטוזיס ראשוני ומשולב אצל ילדים לרוב מתפתחות במהירות עם התפתחות של אי ספיקת לב חמורה. פעילות נמוכה, עייפות של הילד, סירוב להניק עקב עייפות מהירה, תיאבון ירוד, הזעה מוגברת מעידים על בריאות לקויה. כל זה מוביל לכך שהילד לא עולה במשקל בצורה טובה. עור התינוק חיוור עד כאב, בחלקם עם גוון כחלחל, לרוב במשולש הנזולביאלי.
ישנם סימנים של חסינות לקויה, ולכן ילדים כאלה נדבקים לעתים קרובות ובמהירות בזיהומים בדרכי הנשימה, מה שמסבך את המצב. לפעמים בימים ובחודשים הראשונים לחייו, הילד אינו מראה הפרעות במחזור הדם, אך זיהומים תכופים ומחלות ריאה הופכות לטריגר להתפתחות אי ספיקת לב.
בדיקות בריאות נוספות של יילודים וילדים צעירים עם חשד לפיברואלסטוזיס או שאובחנו בעבר הראו לחץ דם נמוך (היפוטנסיה), גודל לב מוגדל (קרדיומגליה), צלילים עמומים בעת האזנה ללב, לעיתים אוושה סיסטולית האופיינית לאי ספיקת מסתם מיטרלי, טכיקרדיה, קוצר נשימה. האזנה לריאות מראה נוכחות של צפצופים, המצביעים על גודש.
נזק אנדוקרדיאלי לחדר השמאלי מוביל לעיתים קרובות להיחלשות שכבת השרירים של הלב (שריר הלב). קצב הלב התקין מורכב משני צלילים מתחלפים בקצב. עם פיברואלסטוזיס, עשוי להופיע צליל שלישי (ולפעמים רביעי). קצב פתולוגי כזה נשמע בבירור ודומה בצלילו להליכה בת שלוש פעימות של סוס (דהרה), ולכן הוא נקרא קצב הדהרה.
תסמין נוסף של פיברואלסטוזיס אצל ילדים צעירים הוא הופעת גיבנת לב. העובדה היא שצלעות הילד בתקופה המוקדמת שלאחר הלידה נותרות לא מאובנות ומיוצגות על ידי רקמת סחוס. העלייה בגודל הלב מובילה לכך שהוא מתחיל ללחוץ על הצלעות ה"רכות", וכתוצאה מכך הן מתכופפות ולוקחות צורה קבועה קדימה (גיבנת לב). עם פיברואלסטוזיס אצל מבוגרים, גיבנת לב אינה נוצרת עקב חוזק ונוקשות רקמת העצם של הצלעות, גם במקרה של עלייה בכל מבני הלב.
היווצרות של גיבנת לב כשלעצמה מעידה רק על מום לב מולד מבלי לציין את טיבו. אך בכל מקרה, היא קשורה לגידול בגודל הלב ובחדריו.
תסמונת בצקת בפיברולסטוזיס אצל ילדים מאובחנת לעיתים רחוקות, אך ילדים רבים חווים כבד מוגדל, שמתחיל לבלוט בממוצע של 3 ס"מ מתחת לקצה קשת הצלעות.
אם נרכשת פיברואלסטוזיס (לדוגמה, זוהי תוצאה של מחלות דלקתיות של קרומי הלב), התמונה הקלינית לרוב מתקדמת באיטיות. במשך זמן מה, התסמינים עשויים להיעדר לחלוטין, ואז מופיעים סימנים חלשים של תפקוד לקוי של הלב בצורה של קוצר נשימה במהלך מאמץ גופני, קצב לב מוגבר, עייפות מהירה וסיבולת גופנית נמוכה. מעט מאוחר יותר, הכבד מתחיל לגדול, מופיעות בצקות וסחרחורת.
כל התסמינים של פיברואלסטוזיס נרכש אינם ספציפיים, דבר המסבך את אבחון המחלה, ודומה לקרדיומיופתיה, מחלת כבד וכליות. המחלה מאובחנת לרוב בשלב של אי ספיקת לב חמורה, דבר המשפיע לרעה על תוצאות הטיפול.
סיבוכים ותוצאות
יש לציין כי פיברואלסטוזיס של הלב והריאות הן פתולוגיות חמורות, שמהלכן תלוי בנסיבות שונות. מומי לב מולדים מסבכים משמעותית את המצב, אשר ניתן לבטל בניתוח בגיל צעיר, אך יחד עם זאת נותר סיכון גבוה למדי למוות (כ-10%).
ההערכה היא שככל שהמחלה מתפתחת מוקדם יותר, כך השלכותיה יהיו חמורות יותר. עובדה זו מאושרת על ידי העובדה שפיברולסטוזיס מולד ברוב המקרים מתפתח באופן חד או חריף עם התקדמות מהירה של אי ספיקת לב. התפתחות אי ספיקת לב חריפה אצל ילד מתחת לגיל 6 חודשים נחשבת לסימן פרוגנוסטי שלילי.
עם זאת, הטיפול אינו מבטיח שיקום מלא של תפקוד הלב, אלא רק מאט את התקדמות תסמיני אי ספיקת הלב. מצד שני, היעדר טיפול תומך כזה מוביל למוות בתוך השנתיים הראשונות לחייו של התינוק.
אם מתגלה אי ספיקת לב בימים ובחודשים הראשונים לחייו של תינוק, סביר להניח שהילד לא ישרוד אפילו שבוע. התגובה לטיפול משתנה בין ילדים. בהיעדר השפעה טיפולית, כמעט ואין תקווה. אך בעזרת העזרה הניתנת, תוחלת החיים של ילד חולה קצרה (ממספר חודשים עד מספר שנים).
ניתוח ותיקון מומי לב מולדים שגרמו לפיברואלסטוזיס בדרך כלל משפרים את מצבו של המטופל. עם טיפול כירורגי מוצלח בהיפרפלזיה של חדר שמאל ועמידה בדרישות הרופא, המחלה עשויה לקבל מהלך שפיר: אי ספיקת לב תהיה בעלת מהלך כרוני ללא סימני התקדמות. אם כי התקווה לתוצאה כזו קטנה.
באשר לצורה הנרכשת של פיברואלסטוזיס לבבי, היא הופכת במהירות לכרונית ומתקדמת בהדרגה. תרופות יכולות להאט את התהליך, אך לא לעצור אותו.
פיברואלסטוזיס ריאתי, ללא קשר לזמן הופעת השינויים בפרנכימה ובקרומים של האיבר לאחר תקופת האור, מתחיל להתקדם במהירות ולמעשה הורג אדם תוך מספר שנים, וגורם לאי ספיקת נשימה חמורה. הדבר העצוב הוא שטרם פותחו שיטות יעילות לטיפול במחלה. [ 7 ]
אבחון פיברואלסטוזיס
פיברואלסטוזיס אנדומיוקרדיאלי, שתסמיניה מתגלים ברוב המקרים בגיל צעיר, היא מחלה מולדת. אם נוציא מכלל מקרים נדירים שבהם המחלה החלה להתפתח בסוף הילדות ובבגרות כסיבוך של פציעות ומחלות סומטיות, ניתן לזהות את הפתולוגיה בתקופה הטרום לידתית, כלומר לפני לידת הילד.
רופאים מאמינים כי שינויים פתולוגיים ברקמות האנדוקרדיאליות, שינויים בצורת לב העובר וכמה מאפיינים של תפקודו, האופייניים לפיברואלסטוזיס, ניתנים לקביעה כבר בשבוע ה-14 להריון. אך עדיין מדובר בתקופה קצרה למדי, ולא ניתן לשלול את האפשרות שהמחלה עלולה להתבטא מעט מאוחר יותר, קרוב יותר לשליש השלישי של ההריון, ולפעמים גם כמה חודשים לפני הלידה. לכן, בעת מעקב אחר נשים בהריון, מומלץ לבצע בדיקות אולטרסאונד קליניות של לב העובר במרווחים של מספר שבועות.
לפי אילו סימנים רופאים יכולים לחשוד במחלה במהלך האולטרסאונד הבא? הרבה תלוי בצורת המחלה. לרוב, פיברואלסטוזיס מאובחנת באזור החדר השמאלי, אך מבנה זה לא תמיד מוגדל. הצורה המורחבת של המחלה עם חדר שמאל מוגדל של הלב נקבעת בקלות במהלך בדיקת אולטרסאונד על ידי הצורה הכדורית של הלב, שקודקודו מיוצג על ידי החדר השמאלי, העלייה הכללית בגודל האיבר ובליטת מחיצת הלב הבין-חדרית לכיוון החדר הימני. אבל הסימן העיקרי לפיברואלסטוזיס הוא עיבוי של האנדוקרדיום, כמו גם מחיצות לב עם עלייה אופיינית באקוגניות של מבנים אלה, אשר נקבעת על ידי בדיקת אולטרסאונד ספציפית.
המחקר מתבצע באמצעות ציוד אולטרסאונד מיוחד עם תוכניות קרדיולוגיה. אקו לב עוברי אינו פוגע באם או בעובר, אלא מאפשר לא רק לזהות שינויים אנטומיים בלב, אלא גם לקבוע את מצב כלי הדם הכליליים, נוכחות קרישי דם בהם ושינויים בעובי קרומי הלב.
אקו לב עוברי נקבע לא רק בנוכחות סטיות במהלך פענוח תוצאות האולטרסאונד, אלא גם במקרה של זיהום של האם (במיוחד ויראלי), נטילת תרופות חזקות, נטייה תורשתית, נוכחות של הפרעות מטבוליות, כמו גם פתולוגיות לב מולדות אצל ילדים גדולים יותר.
אקו לב עוברי יכול לזהות גם צורות מולדות אחרות של פיברואלסטוזיס. לדוגמה, פיברואלסטוזיס של החדר הימני, תהליך נרחב עם נזק בו זמנית לחדר השמאלי ולמבנים סמוכים: החדר הימני, מסתמי הלב, עלייה, צורות משולבות של פיברואלסטוזיס, פיברואלסטוזיס אנדומיוקרדיאלי עם עיבוי הציפוי הפנימי של החדרים ומעורבות של חלק משריר הלב בתהליך הפתולוגי (בדרך כלל בשילוב עם טרומבוז של הדופן).
פיברואלסטוזיס אנדוקרדיאלית שזוהתה בגיל טרום לידתי היא בעלת פרוגנוזה גרועה מאוד, ולכן רופאים ממליצים על הפסקת הריון במקרה זה. האפשרות של אבחנה שגויה נשללת על ידי אולטרסאונד חוזר של לב העובר, המבוצע 4 שבועות לאחר הבדיקה הראשונה שחשפה את הפתולוגיה. ברור שההחלטה הסופית על הפסקת הריון או שמירה על הריון נותרת בידי ההורים, אך עליהם להיות מודעים לאיזה סוג חיים הם גוזרים על הילד.
פיברואלסטוזיס אנדוקרדיאלית לא תמיד מתגלה במהלך ההריון, במיוחד בהתחשב בעובדה שלא כל הנשים ההרות נרשמות למרפאת בריאות האישה ועוברות אבחון אולטרסאונד מונע. מחלת הילד ברחמה כמעט ואינה משפיעה על מצבה של האישה ההרה, כך שלידתו של תינוק חולה הופכת לעתים קרובות להפתעה לא נעימה.
במקרים מסוימים, גם ההורים וגם הרופאים לומדים על מחלת התינוק מספר חודשים לאחר לידתו. במקרה זה, בדיקות דם במעבדה עשויות לא להראות דבר, מלבד עלייה בריכוז הנתרן (היפרנתרמיה). אך תוצאותיהן יהיו שימושיות בביצוע אבחון דיפרנציאלי כדי לשלול מחלות דלקתיות.
עדיין יש תקווה לאבחון אינסטרומנטלי. מחקר סטנדרטי של הלב (אק"ג) אינו אינדיקטיבי במיוחד במקרה של פיברואלסטוזיס. הוא מסייע בזיהוי הפרעות בלב ובמוליכות חשמלית של שריר הלב, אך אינו מציין את הגורמים להפרעות כאלה. לפיכך, שינוי במתח האק"ג (בגיל צעיר יותר הוא בדרך כלל מוערך פחות, בגיל מבוגר יותר - להיפך, גבוה מדי) מצביע על קרדיומיופתיה, שיכולה להיות קשורה לא רק לפתולוגיות לב, אלא גם להפרעות מטבוליות. טכיקרדיה היא סימפטום של מחלות לב. ואם שני חדרי הלב מושפעים, הקרדיוגרמה עשויה להיראות תקינה בדרך כלל. [ 8 ]
טומוגרפיה ממוחשבת (CT) היא כלי מצוין לא פולשני לאיתור הסתיידות קרדיווסקולרית ולשלילת דלקת קרום הלב.[ 9 ]
דימות תהודה מגנטית (MRI) עשוי להיות שימושי באיתור פיברואלסטוזיס מכיוון שביופסיה היא פולשנית. שפת היפויינטנס על רצף פרפוזיה של שריר הלב ושפת היפר-אינטנס על רצף הגברה מושהה מרמזים על פיברואלסטוזיס.[ 10 ]
אבל זה לא אומר שיש לנטוש את המחקר, כי הוא עוזר לקבוע את אופי עבודת הלב ואת מידת התפתחות אי ספיקת הלב.
כאשר מופיעים תסמינים של אי ספיקת לב והמטופל פונה לרופא בנושא, הוא מקבל גם הוראות: צילום רנטגן של החזה, טומוגרפיה ממוחשבת או דימות תהודה מגנטית של הלב, אקו-קרדיוגרפיה (EchoCG). במקרים ספקניים, יש צורך לפנות לביופסיה של רקמת הלב ולאחר מכן בדיקה היסטולוגית. האבחון חמור מאוד, ולכן דורש את אותה גישה לאבחון, אם כי הטיפול אינו שונה בהרבה מטיפול סימפטומטי במחלת לב כלילית ובאי ספיקת לב.
אבל אפילו בדיקה קפדנית שכזו לא תהיה שימושית אם תוצאותיה לא ישמשו באבחון דיפרנציאלי. ניתן להשתמש בתוצאות א.ק.ג. כדי להבדיל בין פיברואלסטוזיס חריפה לבין דלקת שריר הלב אידיופטית, דלקת פריקרדית אקסודטיבית, היצרות אבי העורקים. יחד עם זאת, בדיקות מעבדה לא יראו סימני דלקת (לויקוציטוזיס, שקיעת דם מוגברת וכו'), ומדידות טמפרטורה לא יראו היפרתרמיה.
ניתוח צלילי לב ואוששות, שינויים בגודל הפרוזדורים ומחקר של האנמנזה מסייעים להבחין בין פיברואלסטוזיס אנדוקרדיאלית לבין אי ספיקה מבודדת של המסתם המיטרלי ופגם במסתם המיטרלי.
ניתוח נתונים אנמנסטיים שימושי בהבחנה בין פיברואלסטוזיס לבין היצרות הלב והאאורטה. במקרה של היצרות אבי העורקים, כדאי לשים לב גם לשמירת קצב הסינוס ולהיעדר תרומבואמבוליזם. הפרעות קצב לב ושקיעת תרומבוס אינן נצפות גם בדלקת פריקרדיום תפליטית, אך המחלה מתבטאת בעליית טמפרטורה וחום.
הקושי הגדול ביותר הוא בהבחנה בין פיברואלסטוזיס אנדוקרדיאלית לבין קרדיומיופתיה קונגסטיבית. במקרה זה, פיברואלסטוזיס, למרות שברוב המקרים אינו מלווה בהפרעות הולכה לבביות בולטות, בעלת פרוגנוזה טיפולית פחות טובה.
במקרה של פתולוגיות משולבות, יש לשים לב לכל סטייה שמתגלה במהלך טומוגרפיה או אולטרסאונד של הלב, מכיוון שמומים מולדים מסבכים משמעותית את מהלך הפיברולסטוזיס. אם מזוהה פיברולסטוזיס אנדוקרדיאלית משולבת בתקופה התוך-רחמית, לא ראוי לשמור על ההריון. הרבה יותר אנושי להפסיק אותו.
אבחון פיברואלסטוזיס ריאתי
אבחון של פיברואלסטוזיס ריאתי דורש גם ידע ומיומנויות מסוימים מצד הרופא. העובדה היא שתסמיני המחלה מגוונים למדי. מצד אחד, הם מצביעים על מחלות ריאה (שיעול לא פרודוקטיבי, קוצר נשימה), ומצד שני, הם עשויים להיות גם ביטוי לפתולוגיה לבבית. לכן, אבחון המחלה לא יכול להצטמצם רק לציון תסמינים והאזנה.
בדיקות דם של המטופל מסייעות לשלול מחלות ריאה דלקתיות, אך אינן מספקות מידע על שינויים כמותיים ואיכותיים ברקמות. נוכחות סימנים של אאוזינופיליה מסייעת להבדיל את המחלה מפיברוזיס ריאתי, הדומה בביטוייו, אך אינה דוחה או מאשרת את עובדת הפיברואלסטוזיס.
מחקרים אינסטרומנטליים נחשבים אינדיקטיביים יותר: צילום רנטגן של החזה ובדיקה טומוגרפית של איברי הנשימה, כמו גם ניתוחים פונקציונליים, הכוללים קביעת נפחי נשימה, קיבולת חיונית של הריאות ולחץ באיבר.
במקרה של פיברואלסטוזיס ריאתי, ראוי לשים לב לירידה בתפקוד הנשימה החיצונית, הנמדדת במהלך ספירומטריה. הירידה בחללים האלוואולריים הפעילים משפיעה באופן משמעותי על הקיבולת החיונית של הריאות (VCL), ועיבוי דפנות המבנים הפנימיים משפיע על קיבולת הדיפוזיה של האיבר (DCL), המבטיחה תפקודי אוורור וחילוף גזים (במילים פשוטות, ספיגת פחמן דו-חמצני מהדם ופליטת חמצן).
סימנים אופייניים לפיברואלסטוזיס פלאופרנכימלי הם שילוב של זרימת אוויר מוגבלת לריאות (חסימה) ופגיעה בהתפשטות הריאות במהלך שאיפה (הגבלה), הידרדרות בתפקוד הנשימה החיצונית, יתר לחץ דם ריאתי בינוני (לחץ מוגבר בריאות), המאובחן במחצית מהחולים.
ביופסיה של רקמת הריאה מראה שינויים אופייניים במבנה הפנימי של האיבר. אלה כוללים: פיברוזיס של הצדר והפרנכימה בשילוב עם אלסטוזיס של דפנות האלוואולריות, הצטברות לימפוציטים באזור מחיצות האלוואולריות הדחוסות, טרנספורמציה של פיברובלסטים לרקמת שריר שאינה אופיינית להם, ונוכחות של נוזל בצקתי.
טומוגרמה מראה נזק לריאות בחלקים העליונים בצורת מוקדי דחיסה פלאורלית ושינויים מבניים בפרנכימה. רקמת החיבור המוגדלת של הריאות דומה לרקמת שריר בצבע ובתכונות, אך נפח הריאות פוחת. נמצאים חללים גדולים למדי המכילים אוויר (ציסטות) בפרנכימה. אופייניים להתפשטות מוקדית (או מפושטת) בלתי הפיכה של הסמפונות והברונכיולות (ברונכיאקטזיס מתיחה) ומיקום נמוך של כיפת הסרעפת.
בדיקות רדיולוגיות מגלות אזורים של "זכוכית טחונה" ו"ריאת חלת דבש" אצל חולים רבים, דבר המצביע על אוורור לא אחיד של הריאות עקב נוכחות מוקדי דחיסת רקמות. כמחצית מהחולים סובלים מבלוטות לימפה מוגדלות ובכבד מוגדל.
יש להבדיל בין פיברואלסטוזיס ריאתי לבין פיברוזיס הנגרם על ידי זיהום טפילי ואאוזינופיליה נלווית, פיברואלסטוזיס אנדוקרדיאלית, מחלות ריאה עם אוורור לקוי ותמונה של "ריאת חלת דבש", מחלת היסטיקוטיטיס X (צורה אחת של פתולוגיה זו עם נזק ריאתי נקראת מחלת Hand-Schüller-Christian), ביטויים של סרקואידוזיס ושחפת ריאתית.
יַחַס פיברואלסטוזיס
פיברואלסטוזיס, ללא קשר למיקום שלה, נחשבת למחלה מסוכנת ובלתי ניתנת לריפוי כמעט. שינויים פתולוגיים בפלאורה ובפרנכימה הריאה אינם ניתנים לשיקום באמצעות תרופות. ואפילו שימוש בתרופות נוגדות דלקת הורמונליות (קורטיקוסטרואידים) בשילוב עם מרחיבי סימפונות אינו נותן את התוצאה הרצויה. מרחיבי סימפונות מסייעים להקל מעט על מצבו של המטופל, תוך הקלה על תסמונת החסימה, אך הם אינם משפיעים על התהליכים המתרחשים בריאות, ולכן ניתן להשתמש בהם רק כטיפול תומך.
טיפול כירורגי לפיברואלסטוזיס ריאתי גם הוא אינו יעיל. הניתוח היחיד שיכול לשנות את המצב הוא השתלת איבר מתורם. אך להשתלת ריאות, למרבה הצער, יש את אותה פרוגנוזה שלילית. [ 11 ]
על פי מדענים זרים, פיברואלסטוזיס יכול להיחשב גם כאחד הסיבוכים השכיחים של השתלת תאי גזע של ריאות או מח עצם. בשני המקרים, מתרחשים שינויים בסיבים של רקמת החיבור של הריאות, המשפיעים על תפקוד הנשימה החיצונית.
המחלה מתקדמת ללא טיפול (וטיפול יעיל נעדר כיום), וכ-40% מהחולים מתים מאי ספיקת נשימה תוך 1.5-2 שנים. תוחלת החיים של אלו שנותרים מוגבלת מאוד גם היא (עד 10-20 שנים), וכך גם יכולתם לעבוד. האדם הופך לנכה.
פיברואלסטוזיס לבבי נחשב גם למחלה חשוכת מרפא מבחינה רפואית, במיוחד אם מדובר בפתולוגיה מולדת. בדרך כלל, ילדים אינם חיים עד גיל שנתיים. ניתן להציל אותם רק באמצעות השתלת לב, שהיא כשלעצמה ניתוח קשה עם רמת סיכון גבוהה והשלכות בלתי צפויות, במיוחד בגיל כה צעיר.
אצל חלק מהתינוקות ניתן לתקן מומי לב מולדים בניתוח כדי שלא יחמירו את מצבו של הילד החולה. במקרה של היצרות של העורק, מותקן מרחיב כלי דם - שאנט (מעקף אבי העורקים הכליליים). במקרה של הרחבת החדר השמאלי של הלב, צורתו משוחזרת במהירות. אך גם ניתוח כזה אינו מבטיח שהילד יוכל להסתדר ללא השתלה. כ-20-25% מהתינוקות שורדים, והם סובלים מאי ספיקת לב כל חייהם, כלומר הם אינם נחשבים בריאים.
אם המחלה נרכשת, כדאי להילחם על חייו של הילד בעזרת תרופות. אך חשוב להבין שככל שהמחלה תתבטא מוקדם יותר, כך יהיה קשה יותר להילחם בה.
טיפול תרופתי נועד להילחם ולמנוע החמרות של אי ספיקת לב. לחולים ניתנות התרופות הבאות לטיפול לבבי:
- מעכבי אנזים להמרת אנגיוטנסין (ACE), המשפיעים על לחץ הדם ושומרים עליו בטווח התקין (קפטופריל, אנלפריל, בנזאפריל וכו'),
- חוסמי בטא המשמשים לטיפול בהפרעות קצב לב, יתר לחץ דם עורקי ומניעת אוטם שריר הלב (אנפרילין, ביסופלול, מטופרולול),
- גליקוזידים לבביים, אשר, כאשר משתמשים בהם לאורך זמן, לא רק תומכים בתפקוד הלב (מגדילים את תכולת האשלגן בקרדיומיוציטים ומשפרים את מוליכות שריר הלב), אלא גם מסוגלים להפחית במידה מסוימת את מידת העיבוי האנדוקרדיאלי (דיגוקסין, גיטוקסין, סטרופנטין),
- משתנים חוסכי אשלגן (ספירונולקטון, ורושפירן, דקריז), מניעת בצקת ברקמות,
- טיפול אנטי-תרומבוטי עם נוגדי קרישה (קרדיומגניל, מגניקור), המונע היווצרות קרישי דם והפרעות במחזור הדם בכלי הדם הכליליים.
בצורה המולדת של פיברואלסטוזיס אנדוקרדיאלית, טיפול תומך אינו מקדם החלמה, אך מפחית את הסיכון למוות מאי ספיקת לב או תרומבואמבוליזם ב-70-75%. [ 12 ]
תרופות
כפי שניתן לראות, הטיפול בפיברולסטוזיס אנדוקרדיאלית כמעט ואינו שונה מזה של אי ספיקת לב. בשני המקרים, קרדיולוגים לוקחים בחשבון את חומרת הקרדיופתיה. מרשם תרופות הוא אינדיבידואלי לחלוטין, תוך התחשבות בגיל המטופל, במחלות נלוות, בצורת ובמידת אי ספיקת הלב.
בטיפול בפיברולסטוזיס אנדוקרדיאלית נרכשת, משתמשים בתרופות מ-5 קבוצות. הבה נבחן תרופה אחת מכל קבוצה.
"אנלפריל" היא תרופה מקבוצת מעכבי ACE, המופקת בצורת טבליות במינונים שונים. התרופה מגבירה את זרימת הדם הכליליים, מרחיבה עורקים, מורידה את לחץ הדם מבלי להשפיע על זרימת הדם המוחית, מאטה ומפחיתה את התרחבות החדר השמאלי של הלב. התרופה משפרת את אספקת הדם לשריר הלב, מפחיתה את השפעות האיסכמיה, מפחיתה מעט את קרישת הדם, מונעת היווצרות קרישי דם, ובעלת השפעה משתנת קלה.
במקרה של אי ספיקת לב, התרופה נקבעת לתקופה של יותר משישה חודשים או באופן קבוע. התרופה מתחילה במינון מינימלי (2.5 מ"ג), ומגדילה בהדרגה ב-2.5-5 מ"ג כל 3-4 ימים. המינון הקבוע יהיה זה הנסבל היטב על ידי המטופל וישמור על לחץ הדם בטווח הנורמלי.
המינון היומי המקסימלי הוא 40 מ"ג. ניתן ליטול אותו פעם אחת או לחלק אותו לשתי מנות.
אם לחץ הדם נמוך מהנורמה, המינון מופחת בהדרגה. אין להפסיק את הטיפול באנלפריל בפתאומיות. מומלץ ליטול מינון תחזוקה של 5 מ"ג ליום.
התרופה מיועדת לטיפול בחולים בוגרים, אך ניתן לרשום אותה גם לילד (הבטיחות לא נקבעה רשמית, אך במקרה של פיברואלסטוזיס, חייו של מטופל קטן נמצאים בסכנה, ולכן יחס הסיכון נלקח בחשבון). מעכב ACE אינו רשום לחולים עם חוסר סבילות למרכיבי התרופה, עם פורפיריה, הריון ובמהלך הנקה. אם למטופל הייתה בעבר בצקת אנגיואיד בזמן נטילת תרופות כלשהן מקבוצה זו, אסור להשתמש באנלפריל.
יש לנקוט משנה זהירות בעת מתן התרופה לחולים עם פתולוגיות נלוות: מחלות כליות וכבד קשות, היפרקלמיה, היפראלדוסטרוניזם, היצרות מסתם אבי העורקים או המסתם המיטרלי, פתולוגיות של רקמת חיבור מערכתית, איסכמיה לבבית, מחלות מוח, סוכרת.
בעת טיפול בתרופה, אין ליטול משתנים קונבנציונליים כדי למנוע התייבשות ואפקט היפוטנסיבי חזק. מתן בו זמנית עם משתנים חוסכי אשלגן דורש התאמת מינון, מכיוון שקיים סיכון גבוה להיפרקלמיה, אשר בתורה מעוררת הפרעות קצב לב, התקפים, ירידה בטונוס שרירים, חולשה מוגברת וכו'.
התרופה "אנלפריל" נסבלת בדרך כלל היטב, אך חלק מהמטופלים עלולים לחוות תופעות לוואי. הנפוצות ביותר הן: ירידה חזקה בלחץ הדם עד כדי קריסה, כאבי ראש וסחרחורת, הפרעות שינה, עייפות מוגברת, אובדן הפיך של שיווי משקל, שמיעה וראייה, הופעת טינטון, קוצר נשימה, שיעול ללא הפרשת כיח, שינויים בהרכב הדם והשתן, שבדרך כלל מצביעים על תפקוד לקוי של הכבד והכליות. אפשרי: נשירת שיער, ירידה בחשק המיני, תסמינים של "גלי חום" (תחושת חום ודפיקות לב, היפרמיה של עור הפנים וכו').
"ביסופלול" הוא חוסם בטא בעל פעולה סלקטיבית, בעל השפעות היפוטנסיביות ואנטי-איסכמיות, המסייע להילחם בביטויים של טכיקרדיה והפרעות קצב. תרופה זולה בצורת טבליות, המונעת את התקדמות אי ספיקת הלב בפיברולסטוזיס אנדוקרדיאלית. [ 13 ]
כמו תרופות רבות אחרות הנרשמות למחלת לב כלילית ואי ספיקת לב, ביסופרולול נרשם לטווח ארוך. מומלץ ליטול אותו בבוקר לפני או במהלך הארוחות.
באשר למינונים המומלצים, הם נבחרים באופן אינדיבידואלי בהתאם לקריאות לחץ הדם ולתרופות הנרשמות במקביל לתרופה זו. בממוצע, מינון יחיד (גם יומי) הוא 5-10 מ"ג, אך עם עלייה קלה בלחץ ניתן להפחיתו ל-2.5 מ"ג. המינון המקסימלי שניתן לרשום לחולה עם כליות מתפקדות כרגיל הוא 20 מ"ג, אך רק עם לחץ דם גבוה באופן עקבי.
הגדלת המינונים המצוינים אפשרית רק באישור רופא. אך במקרה של מחלות כבד וכליות קשות, 10 מ"ג נחשבים למינון המרבי המותר.
בטיפול מורכב באי ספיקת לב על רקע תפקוד לקוי של חדר שמאל, המתרחש לרוב עם פיברואלסטוזיס, נבחר מינון יעיל על ידי הגדלה הדרגתית של המינון ב-1.25 מ"ג. במקרה זה, מתחילים עם המינון המינימלי האפשרי (1.25 מ"ג). המינון עולה במרווחים של שבוע.
כאשר המינון מגיע ל-5 מ"ג, המרווח בין המנות עולה ל-28 ימים. לאחר 4 שבועות, המינון עולה ב-2.5 מ"ג. בהקפדה על מרווח ונורמה אלה, מגיעים ל-10 מ"ג, אותם יצטרך המטופל ליטול למשך זמן רב או באופן קבוע.
אם מינון כזה נסבל היטב, הוא מופחת בהדרגה לרמה נוחה. הפסקת הטיפול בחוסם בטא גם היא לא צריכה להיות פתאומית.
אין לרשום את התרופה במקרה של רגישות יתר לחומרים הפעילים והעזרים של התרופה, אי ספיקת לב חריפה ולא מפוצה, הלם קרדיוגני, חסימת עלייתרובנטריקולרית דרגות 2-3, ברדיקרדיה, לחץ דם נמוך באופן עקבי וכמה פתולוגיות לב אחרות, אסתמה סימפונות קשה, חסימת ברונכו, הפרעות במחזור הדם ההיקפי החמורות, חמצת מטבולית.
יש לנקוט משנה זהירות בעת מתן טיפול מורכב. לכן, שילוב של ביסופרולול עם תרופות אנטי-אריתמיות מסוימות (כינידין, לידוקאין, פניטואין וכו'), אנטגוניסטים לסידן ותרופות להורדת לחץ דם מרכזי אינו מומלץ.
תסמינים והפרעות לא נעימות שעלולות להופיע במהלך הטיפול בביסופרולול: עייפות מוגברת, כאבי ראש, גלי חום, הפרעות שינה, ירידה בלחץ הדם וסחרחורת בעת קימה מהמיטה, אובדן שמיעה, תסמינים במערכת העיכול, הפרעות בכבד ובכליות, ירידה בכוח, חולשת שרירים והתכווצויות. לעיתים מטופלים מתלוננים על הפרעות במחזור הדם ההיקפי, המתבטאות בצורה של ירידה בטמפרטורה או נימול בגפיים, במיוחד באצבעות ובבהונות.
בנוכחות מחלות נלוות של מערכת הסימפונות-ריאה, הכליות, הכבד וסוכרת, הסיכון לתופעות לוואי גבוה יותר, דבר המצביע על החמרה של המחלה.
"דיגוקסין" הוא גליקוזיד לבבי פופולרי וזול המבוסס על צמח אצבעונית, אשר ניתן למכירה אך ורק במרשם רופא (בטבליות) ויש להשתמש בו תחת פיקוחו. טיפול בהזרקה מתבצע בבית חולים במהלך החמרה של מחלת לב כלילית ואי ספיקת לב, טבליות ניתנות באופן קבוע במינונים מינימליים יעילים, מכיוון שלתרופה יש השפעה רעילה ונרקוטית.
ההשפעה הטיפולית מורכבת משינוי עוצמת ומשרעת התכווצויות שריר הלב (נותנת ללב אנרגיה, תומכת בו במצבים איסכמיים). לתרופה יש גם השפעה מרחיבה כלי דם (מפחיתה גודש) ואפקט משתן מסוים, המסייע בהקלה על נפיחות ובהפחתת חומרת אי ספיקת הנשימה, המתבטאת בקוצר נשימה.
הסכנה של דיגוקסין וגליקוזידים לבביים אחרים היא שאם הם נותנים מנת יתר, הם עלולים לעורר הפרעות קצב לב הנגרמות עקב עירור מוגבר של שריר הלב.
במקרה של החמרה של אי ספיקת לב, התרופה ניתנת בצורת זריקות, תוך בחירת מינון אישי תוך התחשבות בחומרת המצב ובגיל המטופל. כאשר המצב מתייצב, עוברים לטבליות.
בדרך כלל, המינון הסטנדרטי של התרופה הוא 0.25 מ"ג. תדירות הנטילה יכולה לנוע בין 1 ל-5 פעמים ביום במרווחים שווים. בשלב החריף של אי ספיקת לב, המינון היומי יכול להגיע ל-1.25 מ"ג, כאשר המצב מתייצב באופן קבוע, יש צורך ליטול מינון תחזוקה של 0.25 (לעיתים רחוקות 0.5) מ"ג ליום.
כאשר רושמים את התרופה לילדים, משקל המטופל נלקח בחשבון. מינון יעיל ובטוח מחושב כ-0.05-0.08 מ"ג לק"ג משקל גוף. אך התרופה אינה ניתנת באופן קבוע, אלא למשך 1-7 ימים.
מינון הגליקוזיד הלבבי צריך להיקבע על ידי רופא, תוך התחשבות במצבו ובגילו של המטופל. יחד עם זאת, מסוכן מאוד להתאים את המינונים באופן עצמאי או ליטול 2 תרופות בעלות השפעה כזו בו זמנית.
"דיגוקסין" אינו מרשם לטיפול בתעוקת חזה לא יציבה, הפרעות קצב חמורות, חסימת AV בדרגה 2-3, טמפונדת לב, תסמונת אדמס-סטוקס-מורגני, היצרות מסתם דו-צניפי מבודדת והיצרות אבי העורקים, אנומליה לבבית מולדת הנקראת תסמונת וולף-פרקינסון-ווייט, קרדיומיופתיה חסימתית היפרטרופית, דלקת אנדו, פרי ומיוקרדיטיס, מפרצת אבי העורקים החזי, היפרקלצמיה, היפוקלמיה וכמה פתולוגיות אחרות. רשימת התוויות נגד היא די ארוכה וכוללת תסמונות עם ביטויים מרובים, כך שההחלטה על אפשרות השימוש בתרופה זו יכולה להתקבל רק על ידי מומחה.
לדיגוקסין יש גם תופעות לוואי. אלה כוללות הפרעות קצב לב (כתוצאה ממינון שנבחר בצורה שגויה ומנת יתר), אובדן תיאבון, בחילות (לעתים קרובות עם הקאות), הפרעות מעיים, חולשה קשה ועייפות גבוהה, כאבי ראש, הופעת "זבובים" מול העיניים, ירידה ברמת טסיות הדם והפרעות קרישת דם, תגובות אלרגיות. לרוב, הופעת תסמינים אלה ואחרים קשורה לנטילת מינונים גדולים של התרופה, ופחות - בטיפול ארוך טווח.
"ספירונולקטון" הוא אנטגוניסט מינרלוקורטיקואידי. יש לו אפקט משתן, המקדם את הפרשת הנתרן, כלור ומים, אך שומר על אשלגן, הנחוץ לתפקוד תקין של הלב, מכיוון שתפקודו המוליך מבוסס בעיקר על יסוד זה. הוא מסייע בהקלה על בצקת. הוא משמש כמסייע באי ספיקת לב.
במקרה של אי ספיקת לב, התרופה נקבעת בהתאם לשלב המחלה. במקרה של החמרה, ניתן לרשום את התרופה הן בצורת זריקות והן בטבליות במינון של 50-100 מ"ג ליום. כאשר המצב מתייצב, נקבע מינון תחזוקה של 25-50 מ"ג למשך זמן ארוך. אם מאזן האשלגן והנתרן מופרע לכיוון ירידה באשלגן, ניתן להגדיל את המינון עד ליצירת ריכוז תקין של יסודות קורט.
ברפואת ילדים, המינון האפקטיבי מחושב על סמך יחס של 1-3 מ"ג ספירונולקטון לקילוגרם ממשקל גופו של המטופל.
כפי שאנו רואים, גם כאן, בחירת המינון המומלץ היא אינדיבידואלית, כפי שקורה במרשם תרופות רבות אחרות המשמשות בקרדיולוגיה.
התוויות נגד לשימוש במשתן עשויות להיות: עודף אשלגן או רמות נמוכות של נתרן בגוף, פתולוגיה הקשורה להיעדר מתן שתן (אנוריה), מחלת כליות חמורה עם תפקוד לקוי. התרופה אינה ניתנת לנשים בהריון ולאמהות מניקות, כמו גם לאלו הסובלות מאי סבילות למרכיבי התרופה.
יש לנקוט משנה זהירות בעת שימוש בתרופה בחולים עם חסימת AV בלב (עלול להחמיר), עודף סידן (היפרקלצמיה), חמצת מטבולית, סוכרת, אי סדירות במחזור החודשי ומחלת כבד.
נטילת התרופה עלולה לגרום לכאבי ראש, נמנום, אובדן שיווי משקל וקואורדינציה של תנועות (אטקסיה), הגדלת בלוטות החלב אצל גברים (גינקומסטיה) ואימפוטנציה, שינויים באופי הווסת, התעבות הקול וצמיחת שיער מוגזמת אצל נשים (הירסוטיזם), כאבים באפיגסטריום והפרעות במערכת העיכול, כאבי בטן, תפקוד לקוי של הכליות וחוסר איזון מינרלי. תגובות עור ותגובות אלרגיות אפשריות.
תופעות לוואי נצפות בדרך כלל כאשר חורגים מהמינון הנדרש. בצקת עלולה להופיע כאשר המינון אינו מספיק.
"מגניקור" היא תרופה המונעת היווצרות קרישי דם, המבוססת על חומצה אצטילסליצילית ומגנזיום הידרוקסיד. אחד האמצעים היעילים לטיפול אנטי-תרומבוטי שנקבע לאי ספיקת לב. יש לה השפעה משככת כאבים, נוגדת דלקת, נוגדת טסיות דם, ומשפיעה על תפקוד הנשימה. מגנזיום הידרוקסיד מפחית את ההשפעה השלילית של חומצה אצטילסליצילית על רירית מערכת העיכול.
במקרה של פיברואלסטוזיס אנדומיוקרדיאלי, התרופה נקבעת למטרות פרופילקטיות, ולכן המינון המינימלי היעיל דבק - 75 מ"ג, התואם לטבליה אחת. במקרה של איסכמיה לבבית עקב היווצרות פקקת והיצרות נוספת של לומן כלי הדם הכליליים, המינון ההתחלתי הוא 2 טבליות, ומינון התחזוקה תואם למינון המונע.
חריגה מהמינון המומלץ מגדילה משמעותית את הסיכון לדימום שקשה לעצור.
המינונים מסומנים לחולים בוגרים בשל העובדה שהתרופה מכילה חומצה אצטילסליצילית, אשר השימוש בה מתחת לגיל 15 עלול להיות בעל השלכות חמורות.
התרופה אינה ניתנת לחולים בילדות ובגיל ההתבגרות המוקדם, במקרה של חוסר סבילות לחומצה אצטילסליצילית ולרכיבים אחרים של התרופה, אסתמה "אספירין" (בהיסטוריה), דלקת קיבה ארוזיבית חריפה, כיב פפטי, דיאתזה דימומית, מחלות כבד וכליות קשות, במקרה של אי ספיקת לב מפוצה חמורה.
במהלך ההריון, מגניקור נקבע רק במקרים של צורך קיצוני ורק בשליש הראשון-שני, תוך התחשבות בהשפעה השלילית האפשרית על העובר ועל מהלך ההריון. בשליש השלישי של ההריון, טיפול כזה אינו רצוי, מכיוון שהוא תורם לירידה בכיווץ הרחם (לידה ממושכת) ויכול לגרום לדימום חמור. העובר עלול לסבול מיתר לחץ דם ריאתי ותפקוד לקוי של הכליות.
תופעות הלוואי של התרופה כוללות תסמינים ממערכת העיכול (דיספפסיה, כאבים אפיגסטריים ובטן, סיכון מסוים לדימום בקיבה עם התפתחות אנמיה מחוסר ברזל). על רקע נטילת התרופה, דימום מהאף, דימום בחניכיים ובאיברי מערכת השתן אפשריים.
מנת יתר עלולה לגרום לסחרחורת, עילפון וצלצולים באוזניים. תגובות אלרגיות אינן נדירות, במיוחד בהקשר של רגישות יתר לסליצילטים. עם זאת, אנפילקסיס ואי ספיקת נשימה הן תופעות לוואי נדירות.
בחירת התרופות בטיפול מורכב והמינונים המומלצים צריכה להיות אינדיבידואלית לחלוטין. יש לנקוט משנה זהירות בטיפול בנשים בהריון, אמהות מניקות, ילדים וחולים קשישים.
רפואה מסורתית והומיאופתיה
פיברואלסטוזיס לבבי היא מחלה קשה וקשה עם מהלך פרוגרסיבי אופייני וכמעט ללא סיכוי להחלמה. ברור כי טיפול יעיל במחלה כזו באמצעות תרופות עממיות אינו אפשרי. מתכוני רפואה מסורתית, המסתכמים בעיקר בטיפול צמחי, יכולים לשמש רק כאמצעי עזר ורק באישור רופא, כדי לא לסבך פרוגנוזה גרועה ממילא.
באשר לתרופות הומאופתיות, השימוש בהן אינו אסור, ויכול להיות חלק מטיפול מקיף באי ספיקת לב. עם זאת, במקרה זה, אנו מדברים לא כל כך על טיפול אלא על מניעת התקדמות אי ספיקת לב.
את התרופות יש לרשום הומאופת מנוסה, ושאלת האפשרות לשלבן בטיפול מורכב נתונה בסמכותו של הרופא המטפל.
אילו תרופות הומיאופתיות עוזרות לעכב את התקדמות אי ספיקת הלב בפיברולסטוזיס? באי ספיקת לב חריפה, הומיאופתים פונים לעזרת התרופות הבאות: ארסן אלבום, אנטימוניום טרטריקום, קרבון וגטאביליס, אצידומת אוקסליקום. למרות הדמיון בין האינדיקציות, בבחירת תרופה יעילה, רופאים מסתמכים על הביטויים החיצוניים של איסכמיה בצורת ציאנוזיס (מידתה ושכיחותה) ועל אופי תסמונת הכאב.
במקרה של אי ספיקת לב (CHF), ניתן לכלול את התרופות הבאות בטיפול התחזוקה: Lachesis ו-Nayu, Lycopus (בשלבים הראשונים של הגדלת הלב), Laurocerasus (לקוצר נשימה במנוחה), Latrodectus mactans (לפתולוגיות מסתמי לב), תכשירים של עוזרר (שימושיים במיוחד עבור נגעים באנדומיוקרדיאלים).
במקרה של דופק חזק, ניתן לרשום את התרופות הבאות לטיפול סימפטומטי: Spigelia, Glonoinum (לטכיקרדיה), Aurum metallicum (ליתר לחץ דם).
כדי להפחית את חומרת קוצר הנשימה, התרופות הבאות עוזרות: גרינדליה, ספונגיה ולהגיס. להקלה על כאבי לב, ניתן לרשום את התרופות הבאות: קקטוס, צראוס, נאיה, קופרום, להקלה על חרדה על רקע זה - אקוניטום. בהתפתחות אסתמה לבבית, מסומנים התרופות הבאות: דיגיטליס, לורוסראסוס, ליקופוס.
מְנִיעָה
מניעת פיברואלסטוזיס נרכש של הלב והריאות מורכבת ממניעה וטיפול בזמן במחלות זיהומיות ודלקתיות, במיוחד כשמדובר בפגיעה באיברים חיוניים. טיפול יעיל במחלה הבסיסית מסייע במניעת השלכות מסוכנות, הכוללות פיברואלסטוזיס. זוהי סיבה מצוינת לדאוג היטב לבריאותכם ולבריאות הדורות הבאים, מה שנקרא עבודה למען עתיד בריא ואריכות ימים.
תַחֲזִית
השינויים ברקמת החיבור הקשורים לפיברואלסטוזיס לבבי וריאתי נחשבים בלתי הפיכים. למרות שחלק מהתרופות יכולות להפחית במידה מסוימת את עובי האנדוקרדיום בטיפול ארוך טווח, הן אינן מבטיחות ריפוי. למרות שהמצב לא תמיד קטלני, הפרוגנוזה עדיין יחסית גרועה. שיעור ההישרדות לאחר 4 שנים הוא 77%. [ 14 ]
הפרוגנוזה הגרועה ביותר, כפי שכבר הזכרנו, היא עם הצורה המולדת של פיברואלסטוזיס לבבי, שבה הביטויים של אי ספיקת לב נראים כבר בשבועות ובחודשים הראשונים לחייו של הילד. רק השתלת לב יכולה להציל את התינוק, וזה כשלעצמו ניתוח מסוכן בתקופה כה מוקדמת, ויש לבצעו לפני גיל שנתיים. ילדים כאלה בדרך כלל אינם חיים זמן רב יותר.
ניתוחים אחרים מאפשרים רק למנוע את מוות מוקדם של הילד (ולא תמיד), אך אינם יכולים לרפא אותו לחלוטין מאי ספיקת לב. המוות מתרחש עם פירוק והתפתחות של אי ספיקת נשימה.
הפרוגנוזה לפיברואלסטוזיס ריאתי תלויה במאפייני המחלה. אם התסמינים מתפתחים במהירות, הסיכויים קטנים ביותר. אם המחלה מתקדמת בהדרגה, החולה יכול לחיות כ-10-20 שנים, עד להופעת אי ספיקת נשימה עקב שינויים בנאדיות הריאות.
ניתן להימנע מפתולוגיות רבות וקשות לטיפול אם ננקטים באמצעי מניעה. במקרה של פיברואלסטוזיס לבבי, מדובר, קודם כל, במניעת אותם גורמים שיכולים להשפיע על התפתחות הלב ומערכת הדם של העובר (למעט נטייה תורשתית ומוטציות, שנגדן הרופאים חסרי אונים). אם לא ניתן להימנע מהן, אבחון מוקדם מסייע בזיהוי הפתולוגיה בשלב בו הפסקת הריון אפשרית, דבר שבמצב זה נחשב אנושי.

