מנגנונים גנטיים חדשים עשויים לספק מטרות טיפוליות נגד גליומה
סקירה אחרונה: 14.06.2024

כל תוכן iLive נבדק מבחינה רפואית או נבדק למעשה כדי להבטיח דיוק עובדתי רב ככל האפשר.
יש לנו קווים מנחים קפדניים המקור רק קישור לאתרים מדיה מכובד, מוסדות מחקר אקדמי, בכל עת אפשרי, עמיתים מבחינה רפואית מחקרים. שים לב שהמספרים בסוגריים ([1], [2] וכו ') הם קישורים הניתנים ללחיצה למחקרים אלה.
אם אתה סבור שתוכן כלשהו שלנו אינו מדויק, לא עדכני או מפוקפק אחרת, בחר אותו ולחץ על Ctrl + Enter.
מחקר מהמעבדה של שי-יואן צ'נג, PhD, פרופסור בחטיבת קן ורות דייווי לנוירו-אונקולוגיה במחלקה לנוירולוגיה, זיהה מנגנונים חדשים העומדים בבסיס אירועי שחבור אלטרנטיביים של RNA בתאי גידול גליומה שעשויים לשמש כ מטרות טיפוליות חדשות. תוצאות המחקר מתפרסמות בJournal of Clinical Investigation.
"מצאנו דרך אחרת לטפל בגליומה דרך עדשת השחבור האלטרנטיבי וגילינו מטרות חדשות שלא זוהו בעבר אך חשובות לממאירות גליומה." אמר שיאו סונג, MD, PhD, פרופסור חבר לנוירולוגיה והמחבר הראשי של המחקר.
גליומות הן הסוג הנפוץ ביותר של גידול ראשוני במוח במבוגרים ומקורן בתאי גליה, הנמצאים במערכת העצבים המרכזית ותומכים בתאי עצב סמוכים. גליומות עמידות גבוהה לטיפולים סטנדרטיים, כולל הקרנות וכימותרפיה, בשל ההטרוגניות הגנטית והאפיגנטית של הגידול, מה שמדגיש את הצורך למצוא מטרות טיפוליות חדשות.
מחקרים קודמים של מעבדת צ'נג, שפורסמו במחקר הסרטן, הראו שגורם השחבור החשוב SRSF3 מוגבר באופן משמעותי בגליומות בהשוואה למוח נורמלי, ומווסת SRSF3 שחבור RNA מקדם צמיחה והתקדמות גליומה על ידי השפעה על תהליכים תאיים מרובים בתאי גידול.
חבורת RNA הוא תהליך הכולל הסרה של אינטרונים (אזורים שאינם מקודדים של RNA) וחיבור של אקסונים (אזורי קידוד) ליצירת מולקולת mRNA בוגרת התומכת בביטוי גנים בתא.
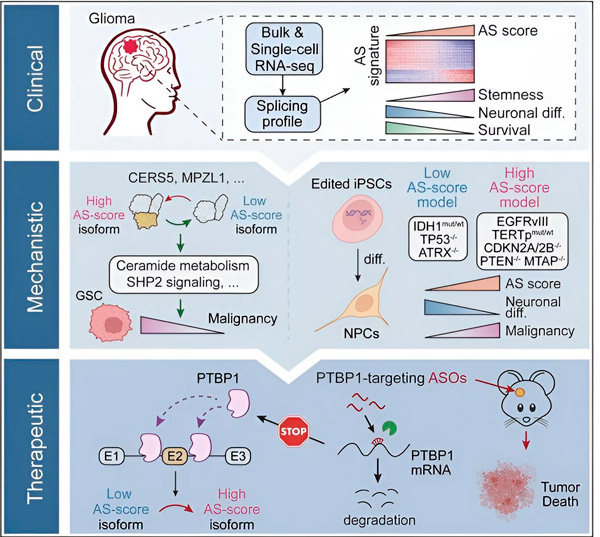
במחקר הנוכחי, המדענים יצאו לזהות שינויים בחבור אלטרנטיבי בתאי גידול גליומה, את המנגנונים העומדים בבסיס השינויים הללו, ולקבוע את הפוטנציאל שלהם כמטרות טיפוליות.
באמצעות שיטות חישוביות וטכנולוגיות רצף RNA, החוקרים בחנו שינויים בחבור בתאי גידול גליומה מדגימות של חולים. כדי לאשר את השינויים הללו, הם השתמשו בטכנולוגיות לעריכת גנים של CRISPR כדי להכניס מוטציות שונות של מובילי גליומה לתוך מודלים של תאי גזע פלוריפוטנטיים (iPSC) שמקורם בגליומה.
הם מצאו ששינויי השחבור הללו מוגברים על ידי וריאנט של קולטן גורם הגדילה האפידרמיס III (EGFRIII), הידוע כביטוי יתר בגידולים רבים, כולל גליומות, ומעוכב על ידי מוטציה בגן IDH1. p>
החוקרים אישרו את התפקוד של שני אירועי שחבור של RNA היוצרים איזופורמים שונים של חלבון עם רצפים שונים של חומצות אמינו.
"רק אחד מהאיזופורמים הללו יכול לקדם את צמיחת הגידול, בניגוד לאיזופורם האחר, שבדרך כלל מתבטא במוח התקין. גידולים משתמשים במנגנון זה כדי לבטא באופן סלקטיבי את האיזופורם המעודד את הגידול על פני האיזופורם הרגיל של המוח," סונג אמר.
הצוות ניתח בשלב הבא חלבונים קושרי RNA במעלה הזרם ומצא שהגן PTBP1 מווסת שחבור RNA מעודד גידול בתאי גליומה. באמצעות מודל עכבר בעל חוסר חיסוני אורתוטופי של גליומה, החוקרים פנו ל-PTBP1 עם טיפול ב-antisense oligonucleotide (ASO), שבסופו של דבר דיכא את צמיחת הגידול.
"הנתונים שלנו מדגישים את התפקיד של שחבור RNA אלטרנטיבי בהשפעה על ממאירות גליומה והטרוגניות ואת הפוטנציאל שלו כפגיעות טיפולית לטיפול בגליומות מבוגרים", כתבו מחברי המחקר.
החוקרים מתכננים בהמשך לבחון את הפוטנציאל של התמקדות ב-PTBP1 כדי לגרום לתגובה חיסונית אנטי-גידולית, אמר סונג.
"באמצעות ניתוח RNA-seq שנקרא ארוכות, גילינו כי מיקוד ל-PTBP1 בתאי גליומה מביא לייצור של תמלילים שחבורים רבים לחלופין, אשר נעדרים ברקמות נורמליות. לכן, הפרויקט הבא שלנו הוא לגלות האם האיזופורם הזה יכול ליצור כמה אנטיגנים." כדי שמערכת החיסון תוכל לזהות טוב יותר את הגידול", אמר סונג.
שיר גם הוסיפה שהצוות שלה מעוניין לנתח שינויים שחבור בתאים שאינם גידולים מחולי גליומה, כגון תאי חיסון.
"אנחנו כבר יודעים שחבור חשוב מאוד לוויסות תפקוד בתא, ולכן הוא צריך לא רק לווסת את ממאירות הגידול, אלא גם יכול לווסת את תפקוד תאי החיסון כדי לקבוע אם הם יכולים להרוג סרטן ביעילות. אז אנחנו גם עושה כמה ניתוחים ביואינפורמטים בתאי חיסון שחדרו לגידול כדי לגלות אם יש שינוי בחבור לאחר שהתא החיסון חדר לגידול.
"המטרה שלנו היא לקבוע את התפקיד של שחבור חלופי בעיצוב המיקרו-סביבה של הגידול המדכא את מערכת החיסון ולזהות מטרות פוטנציאליות לשיפור היעילות של אימונותרפיות בגליומה", אמר סונג.
