פרסומים חדשים
מחקר מדגיש את הצורך בטיפולים ספציפיים לסוגי תאים עבור HIV
סקירה אחרונה: 02.07.2025

כל תוכן iLive נבדק מבחינה רפואית או נבדק למעשה כדי להבטיח דיוק עובדתי רב ככל האפשר.
יש לנו קווים מנחים קפדניים המקור רק קישור לאתרים מדיה מכובד, מוסדות מחקר אקדמי, בכל עת אפשרי, עמיתים מבחינה רפואית מחקרים. שים לב שהמספרים בסוגריים ([1], [2] וכו ') הם קישורים הניתנים ללחיצה למחקרים אלה.
אם אתה סבור שתוכן כלשהו שלנו אינו מדויק, לא עדכני או מפוקפק אחרת, בחר אותו ולחץ על Ctrl + Enter.
חוקרים מאוניברסיטת אילינוי הדגימו את החשיבות של מיקוד בסוגי תאים ספציפיים בטיפול ב-HIV. מחקרם, שפורסם בכתב העת Proceedings of the National Academy of Sciences, הוא אחד הראשונים שבחנו את ההשפעות הדיפרנציאליות או הספציפיות לסוג תא של אפנון חביון HIV על תאים מיאלואידים, סוג של תא חיסון המיוצר במח העצם.
אחד המכשולים העיקריים לחיסול הדבקה ב-HIV הוא ניהול תקופת הלטנטיות, או התקופה שבה תא נגוע רדום ואינו יכול לייצר וירוס. תאי HIV סמויים מצטברים בגוף במקומות המכונים מאגרים. מאגרים סמויים הם בעייתיים משום שהם יכולים להתחיל לייצר וירוס בכל עת.
מיגור מוחלט של המחלה ידרוש הסרה של כל התאים הסמויים מהגוף או עמידות קבועה לגירויי הפעלה. עם זאת, הפעלה מחדש יכולה להיות מופעלת על ידי מגוון גורמים, כולל אותות המכוונים את התמיינות תאי המיאלואידים.
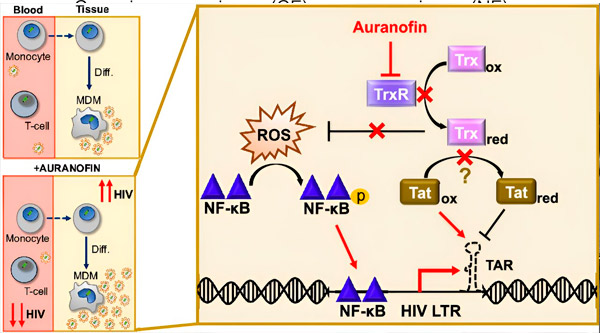
ויסות זמן החביון של HIV במקרופאגים שמקורם במונוציטים (MDMs) עלול להוות סיכון להפצת הנגיף. התמיינות של מונוציטים למקרופאגים יכולה לעורר הפעלה מחדש של HIV, מה שעלול לקדם את הפצת הנגיף ברקמות (למעלה משמאל). מועמד קליני, Auranofin, מפחית את ה-DNA הנגיפי בדם ומקדם חביון של HIV בתאי T ובמונוציטים, אך גורם להפעלה מחדש של HIV ב-MDMs (למטה משמאל). ב-MDMs, אנו משערים שעיכוב של TrxR על ידי Auranofin מוביל להצטברות של מיני חמצן פעילים (ROS), אשר משרים להפעלת NF-κB ולהפעלת מקדם LTR של HIV (מימין). עיכוב של TrxR עלול להפחית את הפחתת הסובסטרט, מה שמאפשר לחלבון Tat להישאר מחומצן באופן מועדף, שם הוא יכול להיקשר ל-TAR וליזום שעתוק HIV. מקור: Proceedings of the National Academy of Sciences (2024). DOI: 10.1073/pnas.2313823121
במשך שנים, מחקר ריפוי HIV התמקד בשתי גישות המכונות "הלם והרג" ו"חסימה ונעילה". הראשונה פועלת בשילוב עם טיפול אנטי-רטרוויראלי כדי להפעיל תאים נגועים באופן סמוי ולהרוג אותם באמצעות אפופטוזיס, או מוות תאי מתוכנת, בעוד שהשנייה מאלצת תאים נגועים למצב סמוי עמוק שממנו הם אינם יכולים להפעיל מחדש בעצמם.
מחקר סביב טכניקות אלו התמקד באופן מסורתי בסוג של תאי דם לבנים הנקראים תאי T, שהם המטרה העיקרית של זיהום HIV. עם זאת, מאגרים סמויים מורכבים יותר מתאי T בלבד; למעשה, הם מכילים עשרות סוגי תאים שונים, שלכל אחד מהם דפוסים ייחודיים משלו של ביטוי גנים של HIV.
"יש מגוון עצום של תאים, אפילו בתוך שושלת אחת", אמר קולין קיפר, פרופסור למיקרוביולוגיה ואחד ממחברי המאמר. "השונות של התגובה במאגרים אלה עולה עם כל סוג תא חדש".
אלכסנדרה בלנקו, סטודנטית לתואר שני במעבדה של קיפר, רצתה לחקור סוגי תאים שלא זוהו במחקר המסורתי של HIV. תוך התמקדות בתאים מיאלואידים, היא יצרה ספריית שיבוטים המכילה 70 אוכלוסיות של מונוציטים נגועים באופן סמוי. לאחר מכן, בלנקו ניתחה את אוכלוסיות השיבוטים ואת תגובותיהן להפעלה. התגובות היו מגוונות מאוד, מה שהדגיש את הגיוון הרב בתוך סוג תא יחיד.
תצפית זו העלתה שאלה חדשה: האם סוגי תאים שונים באמת מגיבים בצורה שונה לטיפולי חביון ב-HIV? ואכן, ממצאיהם הראו כי חלק מטיפולי החביון ב-HIV יכולים לקדם חביון בתאי T ובמונוציטים, בעוד שהם יכולים להפוך את החביון במקרופאגים.
"לא כל התאים בגוף זהים", אמר קיפר. "לכן הגיוני שלא כל התאים הנגועים יגיבו לנגיף באותו אופן."
המאמר שלהם מדגיש את הצורך שטיפולי HIV עתידיים יתחשבו בכל סוגי התאים וכיצד כל תא עשוי להגיב לטיפולים פוטנציאליים.
ממצאיהם מתבססים על מחקר של רוי דאר, פרופסור לשעבר להנדסה ביו-רפואית באילינוי, שמעבדתו חקרה הטרוגניות בביטוי גנים של HIV.
"הוא התחיל את זה, ואנחנו לקחנו את זה על עצמנו ובנינו את זה עד למקום שבו זה היום", אמר קיפר. "אז שיתוף הפעולה באמת התחיל את התוצאות האלה. זה הפך לכיוון חדש עבור המעבדה שלנו, ואנחנו ממש מתרגשים מזה."
ממצא נוסף ובלתי צפוי מניתוחו של בלנקו גילה שינויים בגודל ובצורת התאים בתגובה לזיהום, דבר המצביע על כך ש-HIV יכול לשנות את המורפולוגיה של התאים. מטרתו הבאה של בלנקו היא לזהות את המנגנונים הביולוגיים העומדים בבסיס השינויים הפנוטיפיים הללו.
קיפר וחבריו במעבדה מצפים גם לשחזר את תוצאותיהם, שנעשו בעיקר בשורת תאים, בתאים ראשוניים. שחזור התוצאות במודל דמוי אדם יותר ישפר את הרלוונטיות הקלינית של המחקר, הסביר קיפר.
"אנחנו רוצים לבצע בדיקות סקר גדולות יותר בתאי T, מונוציטים ומקרופאגים כדי לזהות תרופות פוטנציאליות שעשויות לעבוד על כל סוגי התאים הללו", אמר בלנקו. "ייתכן שנמצא אפילו יותר מולקולות שאינן מתנהגות באופן ספציפי לסוג תא."
