פרסומים חדשים
מוטציה בגן ARID1A הופכת גידולים לרגישים לאימונותרפיה
סקירה אחרונה: 02.07.2025

כל תוכן iLive נבדק מבחינה רפואית או נבדק למעשה כדי להבטיח דיוק עובדתי רב ככל האפשר.
יש לנו קווים מנחים קפדניים המקור רק קישור לאתרים מדיה מכובד, מוסדות מחקר אקדמי, בכל עת אפשרי, עמיתים מבחינה רפואית מחקרים. שים לב שהמספרים בסוגריים ([1], [2] וכו ') הם קישורים הניתנים ללחיצה למחקרים אלה.
אם אתה סבור שתוכן כלשהו שלנו אינו מדויק, לא עדכני או מפוקפק אחרת, בחר אותו ולחץ על Ctrl + Enter.
אימונותרפיה חוללה מהפכה בטיפול בסרטן בשנים האחרונות. במקום לכוון ישירות לגידולים, אימונותרפיה מכוונת את מערכת החיסון של החולים לתקוף גידולים בצורה יעילה יותר. זה יעיל במיוחד עבור סוגי סרטן מסוימים שקשה לטפל בהם. עם זאת, פחות ממחצית מחולי הסרטן מגיבים לאימונותרפיות הנוכחיות, מה שיוצר צורך דחוף לזהות סמנים ביולוגיים שיכולים לחזות אילו חולים ייהנו יותר מהטיפול.
לאחרונה, מדענים שמו לב כי חולים שבגידולים שלהם יש מוטציה בגן ARID1A נוטים יותר להגיב באופן חיובי לחסימת נקודות בקרה חיסוניות, סוג של אימונותרפיה שפועלת על ידי שמירה על פעילות תאי חיסון הנלחמים בסרטן.
מכיוון שמוטציית הגן ARID1A קיימת בסוגי סרטן רבים, כולל סרטן רירית הרחם, סרטן השחלות, סרטן המעי הגס, סרטן הקיבה, סרטן הכבד והלבלב, חוקרי מכון סאלק תהו כיצד היא עשויה לתרום לרגישות הטיפול וכיצד רופאים יכולים להשתמש במידע זה כדי להתאים אישית את הטיפול בסרטן לכל חולה.
המחקר החדש שלהם, שפורסם בכתב העת Cell, מראה כי המוטציה ARID1A הופכת גידולים לרגישים לאימונותרפיה על ידי גיוס תאי חיסון הנלחמים בסרטן לגידול באמצעות תגובה חיסונית דמוית אנטי-ויראלית.
החוקרים מציעים כי מוטציה זו והתגובה החיסונית האנטי-ויראלית יוכלו לשמש כסמן ביולוגי לבחירה טובה יותר של חולים לאימונותרפיות ספציפיות, כגון חסימת נקודות בקרה חיסוניות. ממצאים אלה גם מעודדים פיתוח תרופות המכוונות ל-ARID1A ולחלבונים קשורים כדי להפוך גידולים אחרים לרגישים יותר לאימונותרפיה.
"זה יכול לשנות באמת את תוצאות הטיפול בסרטן עבור חולים", אמרה פרופסור חבר דיאנה הרגריבס, מחברת המחקר הבכירה. "לחולים עם המוטציה ARID1A כבר יש תגובה חיסונית, ולכן כל מה שאנחנו צריכים לעשות הוא לחזק את התגובה הזו באמצעות חסימת נקודות בקרה חיסוניות כדי לעזור להם להשמיד את הגידולים שלהם מבפנים."
למרות שהיה ידוע שאנשים עם מוטציות ARID1A הגיבו היטב לחסימת נקודות בקרה חיסוניות, הקשר המדויק בין השניים נותר לא ברור. כדי לשפוך אור על המנגנון, מדענים במכון סאלק השתמשו במודלים של עכברים של מלנומה וסרטן המעי הגס עם מוטציית ARID1A וגם עם ARID1A פונקציונלי.
מקור: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
הצוות צפה בתגובה חיסונית חזקה בכל המודלים עם המוטציה ARID1A, אך לא באלו שבהם ARID1A היה פונקציונלי, דבר התומך ברעיון שהמוטציה ARID1A אכן מניעה תגובה זו. אבל כיצד זה עובד ברמה המולקולרית?
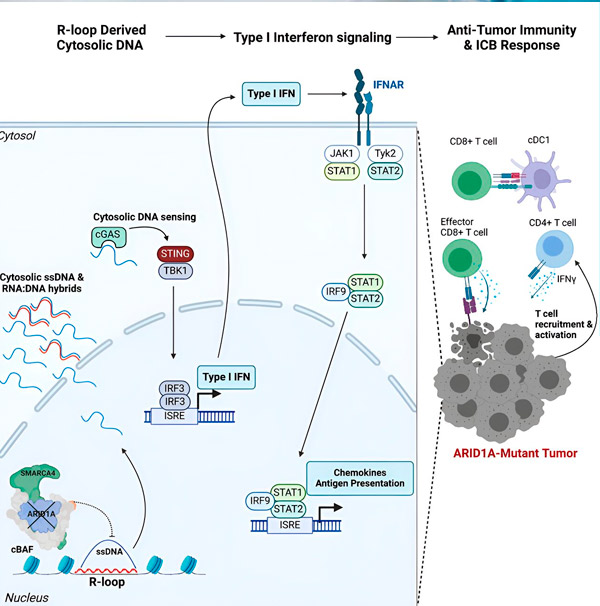
"מצאנו כי ARID1A ממלא תפקיד חשוב בגרעין התא על ידי שמירה על ארגון תקין של ה-DNA", אומר מתיו מקסוול, המחבר הראשון של המחקר וסטודנט לתואר שני במעבדת הרגריבס. "ללא ARID1A פונקציונלי, DNA חופשי יכול להיכרת ולשחרר אותו לציטוזול, מה שמפעיל תגובה חיסונית אנטי-ויראלית רצויה שניתן לשפר אותה על ידי חסימת נקודות בקרה חיסוניות."
הגן ARID1A מקודד לחלבון המסייע לווסת את צורת ה-DNA שלנו ולשמור על יציבות הגנום. כאשר ARID1A עובר מוטציה, הוא מפעיל שרשרת אירועים דמוית רוב גולדברג בתאי סרטן.
ראשית, היעדר ARID1A פונקציונלי גורם לשחרור DNA לציטוזול. לאחר מכן, ה-DNA הציטוזולי מפעיל מערכת אזעקה אנטי-ויראלית, מסלול cGAS-STING, מכיוון שהתאים שלנו מותאמים לסמן כל DNA בציטוזול כזר כדי להגן מפני זיהומים ויראליים. בסופו של דבר, מסלול cGAS-STING מפעיל את מערכת החיסון כדי לגייס תאי T לגידול ולהפעיל אותם לתאי T רוצחי סרטן ייעודיים.
בכל שלב, בהתאם לשלב הקודם, שרשרת אירועים זו - מוטציה ב-ARID1A, בריחת DNA, אזעקת cGAS-STING, גיוס תאי T - מובילה לעלייה במספר תאי ה-T הנלחמים בסרטן בגידול. לאחר מכן ניתן להשתמש בחסימת נקודות בקרה חיסוניות כדי להבטיח שתאי T אלה יישארו פעילים, ובכך לשפר את יכולתם להביס את הסרטן.
"הממצאים שלנו מספקים מנגנון מולקולרי חדש שבאמצעותו מוטציה ב-ARID1A עשויה לתרום לתגובה חיסונית אנטי-גידולית", אומר הרגריבס. "מה שמרגש בממצאים אלה הוא הפוטנציאל התרגומי שלהם. אנו יכולים להשתמש במוטציות ב-ARID1A כדי לבחור חולים לחסימת נקודות בקרה חיסוניות, וכעת אנו רואים מנגנון שבאמצעותו תרופות המעכבות את ARID1A או את קומפלקס החלבונים שלו יכולות לשמש לשיפור נוסף של אימונותרפיה בחולים אחרים."
על ידי תיאור המנגנון שבו חסימת נקודות בקרה חיסוניות יעילה יותר בסרטן עם מוטציה ב-ARID1A, החוקרים מספקים לרופאים רציונל לתעדוף אימונותרפיה זו עבור חולים עם מוטציה ב-ARID1A. ממצאים אלה הם צעד חשוב לקראת התאמה אישית של טיפול בסרטן ומעוררים השראה לפיתוח טיפולים חדשים המכוונים ל-ARID1A ולקומפלקס החלבונים שלו.
בהמשך, צוות מכון סאלק מקווה שממצאיהם ישפרו את תוצאות הטיפול עבור חולים עם סוגים שונים של סרטן הקשורים למוטציות ARID1A, ומתכוון לחקור תרגום קליני זה בשיתוף פעולה עם אוניברסיטת קליפורניה, סן דייגו.
