פרסומים חדשים
חלבון מפתח זוהה כמונע אובדן מסת עצם באוסטאופורוזיס
סקירה אחרונה: 02.07.2025

כל תוכן iLive נבדק מבחינה רפואית או נבדק למעשה כדי להבטיח דיוק עובדתי רב ככל האפשר.
יש לנו קווים מנחים קפדניים המקור רק קישור לאתרים מדיה מכובד, מוסדות מחקר אקדמי, בכל עת אפשרי, עמיתים מבחינה רפואית מחקרים. שים לב שהמספרים בסוגריים ([1], [2] וכו ') הם קישורים הניתנים ללחיצה למחקרים אלה.
אם אתה סבור שתוכן כלשהו שלנו אינו מדויק, לא עדכני או מפוקפק אחרת, בחר אותו ולחץ על Ctrl + Enter.
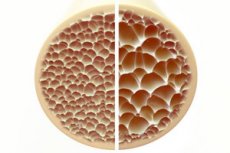
אוסטאופורוזיס, מצב המאופיין בעצמות נקבוביות ושבריריות, מהווה איום משמעותי על בריאות השלד. עצמות, כתמיכה מבנית העיקרית של גוף האדם, מספקות תמיכה חיונית. כאשר מסת העצם יורדת, זה לא רק פוגע בתמיכה זו, אלא גם פוגע בתפקוד הכללי, מה שמוביל לירידה באיכות החיים.
ככל ששיעור האוסטאופורוזיס עולה באוכלוסייה המזדקנת, קיים עומס גובר על משאבי שירותי הבריאות לטיפול ארוך טווח. לכן, יש צורך להבין את המנגנונים התורמים להתפתחות אוסטאופורוזיס ולפתח טיפולים יעילים וממוקדים כדי למזער את השפעתה ארוכת הטווח.
אוסטאובלסטים ואוסטאוקלסטים הם שני סוגי תאים הממלאים תפקיד מפתח בתחזוקה ובעיצוב מחדש של רקמת עצם. בעוד שאוסטאובלסטים הם תאים יוצרי עצם האחראים על סינתזה ושקיעת רקמת עצם חדשה, אוסטאוקלסטים הם תאים מפרקי עצם המעורבים בפירוק והסרה של רקמת עצם ישנה או פגומה.
עלייה בשיעור האוסטאוקלסטים מובילה לאובדן עצם במצבים כמו אוסטאופורוזיס, דלקת מפרקים שגרונית (דלקת במפרקים) וגרורות בעצמות (סרטן שהתפשט לעצמות). אוסטאוקלסטים נוצרים מהתמיינות של מקרופאגים או מונוציטים, שהם סוגים של תאי חיסון.
לפיכך, עיכוב התמיינות אוסטאוקלסטים עשוי לשמש כאסטרטגיה טיפולית למניעת אובדן עצם. עם זאת, המנגנונים המולקולריים המדויקים המווסתים את התהליך המורכב של שיפוץ עצם נותרו לא ברורים.
במחקר חדש, פרופסור טדאיושי היאטה, מר טאקוטו קונו וגב' היטומי מוראצ'י מאוניברסיטת טוקיו למדעים, יחד עם עמיתים, התעמקו בוויסות המולקולרי של התמיינות אוסטאוקלסטים. גירוי באמצעות קולטן מפעיל של ליגנד קאפה B (RANKL) גורם להתמיינות של מקרופאגים לאוסטאוקלסטים.
בנוסף, נקשרו מסלולי איתות של חלבון מורפוגנטי של העצם (BMP) וגורם גדילה מתמיר (TGF)-β לוויסות התמיינות אוסטאוקלסטים בתיווך RANKL. במחקר הנוכחי, החוקרים ניסו לחקור את תפקידו של Ctdnep1, אנזים פוספטאז (אנזים המסיר קבוצות פוספט) שדווח כי הוא מדכא מסלולי איתות של BMP ו-TGF-β.
המחקר פורסם בכתב העת Biochemical and Biophysical Research Communications.
פרופסור היאטה מציין: "RANKL משמש כ'מאיץ' להתמיינות אוסטאוקלסטים. נהיגה ברכב דורשת לא רק דוושת גז אלא גם בלמים. כאן, מצאנו ש-Ctdnep1 משמש כ'בלם' בהתמיינות אוסטאוקלסטים."
החוקרים בחנו תחילה את ביטוי Ctdnep1 במקרופאגים של עכברים שטופלו ב-RANKL ובתאי בקרה שלא טופלו. הם הבחינו כי ביטוי Ctdnep1 לא השתנה בתגובה לגירוי RANKL. עם זאת, הוא היה ממוקם בציטופלזמה בצורה גרגירית במקרופאגים והתמיין לאוסטאוקלסטים, בשונה ממיקומו הפרינקלירי הרגיל בסוגי תאים אחרים, דבר המצביע על תפקודו הציטופלזמי בהתמיינות אוסטאוקלסטים.
יתר על כן, דיכוי של Ctdnep1 (ירידה בביטוי גנים) הביא לעלייה במספר האוסטאוקלסטים החיוביים לפוספטאז חומצי עמיד לטרטרט (TRAP), כאשר TRAP הוא סמן של אוסטאוקלסטים מובחנים.
נוקאאוט של Ctdnep1 הביא לעלייה בביטוי של סמני התמיינות מרכזיים, כולל "Nfatc1", גורם שעתוק ראשי המושרה על ידי RANKL להתמיינות אוסטאוקלסטים. תוצאות אלו תומכות ב"פונקציית בלימה" של Ctdnep1, לפיה הוא מווסת באופן שלילי את התמיינות האוסטאוקלסטים. יתר על כן, נוקאאוט של Ctdnep1 הביא גם לספיגת סידן זרחתי מוגברת, דבר המצביע על תפקיד מדכא של Ctdnep1 בספיגת עצם.
לבסוף, למרות שנוקאאוט של Ctdnep1 לא שינה את האיתות של BMP ו-TGF-β, תאים חסרי Ctdnep1 הראו רמות מוגברות של חלבונים זרחניים (מופעלים), שהם תוצרים של מסלול האיתות RANKL. תוצאות אלו מצביעות על כך שההשפעה המעכבת של Ctdnep1 על התמיינות אוסטאוקלסטים עשויה לא להיות מתווכת באמצעות איתות של BMP ו-TGF-β, אלא באמצעות ירידה ברמות מסלול האיתות של RANKL ורמות חלבון Nfatc1.
בסך הכל, תוצאות אלו מספקות תובנות חדשות לגבי תהליך ההתמיינות של אוסטאוקלסטים ומזהות מטרות טיפוליות פוטנציאליות בהן ניתן להשתמש לפיתוח טיפולים להפחתת אובדן עצם עקב פעילות יתר של אוסטאוקלסטים. בנוסף למחלות המאופיינות באובדן עצם, Ctdnep1 זוהה גם כגורם סיבתי במדולובלסטומה, גידול במוח בילדות. המחברים אופטימיים כי ניתן להרחיב את מחקרם למחלות אנושיות אחרות מעבר למטבוליזם של העצם.
פרופסור היאטה מסכם: "תוצאותינו מצביעות על כך ש-Ctdnep1 נדרש כדי למנוע אוסטאוקלסטוגנזה מוגזמת. תוצאות אלו עשויות להרחיב עוד יותר את הידע שלנו על האופן שבו רשת הזרחון-דה-זרחון שולטת בהתמיינות אוסטאוקלסטים ועשויות לספק אסטרטגיות טיפוליות חדשות לטיפול במחלות עצם הקשורות לפעילות מוגזמת של אוסטאוקלסטים."
