פרסומים חדשים
תרופת LM11A-31 מאטה את התקדמות מחלת אלצהיימר בניסוי
סקירה אחרונה: 02.07.2025

כל תוכן iLive נבדק מבחינה רפואית או נבדק למעשה כדי להבטיח דיוק עובדתי רב ככל האפשר.
יש לנו קווים מנחים קפדניים המקור רק קישור לאתרים מדיה מכובד, מוסדות מחקר אקדמי, בכל עת אפשרי, עמיתים מבחינה רפואית מחקרים. שים לב שהמספרים בסוגריים ([1], [2] וכו ') הם קישורים הניתנים ללחיצה למחקרים אלה.
אם אתה סבור שתוכן כלשהו שלנו אינו מדויק, לא עדכני או מפוקפק אחרת, בחר אותו ולחץ על Ctrl + Enter.

במחקר שפורסם לאחרונה בכתב העת Nature Medicine, מדענים ערכו מחקר פאזה 2a אקראי, כפול סמיות, מבוקר פלצבו, כדי לבחון את הבטיחות והיעילות של LM11A-31 בטיפול במחלת אלצהיימר (AD) באמצעות אפנון קולטן הנוירוטרופין p75 (p75NTR).
מחלת אלצהיימר שמתפתחת מאוחר היא הצורה הנפוצה ביותר של דמנציה, המאופיינת בכשל סינפטי, ניוון ואובדן תאי עצב. למרות ששתי התרופות המובילות לטיפול במחלת אלצהיימר מכוונות להצטברות של חלבוני עמילואיד-β או טאו לא תקינים, הן מטפלות רק בחלק מהפתופיזיולוגיה. גישה נוספת כוללת מיקוד בקולטנים וברשתות איתות המשפיעות על מסלולים ביולוגיים בסיסיים. מחקרים פרה-קליניים מראים כי אפנון של p75NTR באמצעות מולקולה כימית קטנה חדשה, LM11A-31, מפחית את האובדן הסינפטי הנגרם על ידי עמילואיד וטאו לא תקין.
תיאור המחקר
בניסוי קליני אקראי זה, החוקרים בחנו האם LM11A-31 יכול להאט את התקדמות מחלת אלצהיימר על ידי ויסות p75NTR בבני אדם.
משתתפי המחקר קיבלו כמוסות LM11A-31 דרך הפה במינונים של 200 מ"ג ו-400 מ"ג או פלצבו ביחס של 1:1:1 ל-242 חולים עם אסתמה קלה עד בינונית במשך 26 שבועות. למשתתפים הייתה מחלת אלצהיימר שאושרה ביולוגית (רמת חלבון עמילואיד β 42 (Aβ42) בנוזל השדרה מתחת ל-550 ננוגרם/ליטר או יחס Aβ42:β40 מתחת ל-0.89) שאובחנה לפי קריטריוני מק'קאן, עם ציוני MMSE (Mini-Psychiatric Examination) של 18 עד 26, ציוני GDS (Griatric Depression Scale) מתחת ל-5.0, ציוני HIS (Hachinski Ischemic Scale) ≤ 4.0, השכלה פורמלית ≥ 8 שנים, וירידה קוגניטיבית קודמת ≥ 6 חודשים.
משתתפים זכאים נטלו מעכבי אצטילכולין אסטראז (AChEIs) או אנטגוניסטים חלקיים לקולטן NMDA במשך 3 חודשים ומעלה לפני כניסתם למחקר. הם לא נטלו סמים אסורים כגון תרופות אנטי-פסיכוטיות, בנזודיאזפינים, תרופות אנטי-אפילפטיות, תרופות הרגעה, תרופות להורדת לחץ דם מרכזי, נוטרופיקות (למעט גינקו בילובה) או משככי כאבים המכילים אופיואידים.
התוצא העיקרי של המחקר היה בטיחות וסבילות, אשר הוערכו באמצעות סולם דירוג חומרת מחשבות אובדניות והתנהגות של קולומביה (C-SSRS), סימנים חיוניים, לחץ דם ופרמטרים המטולוגיים. הדמיית תהודה מגנטית מבנית (cMRI), טומוגרפיה של פליטת פוזיטרונים באמצעות פלואורודאוקסיגלוקוז (FDG-PET) וסמנים ביולוגיים של נוזל מוחי שדרתי (CSF) שימשו להערכת תוצאים קוגניטיביים משניים. מדדי AD כללו טאו פוספורילציה עם Thr181, חלבון טאו כולל, Aβ40, Aβ42 ופעילות AChE. הצוות השתמש במבחן נוירופסיכולוגי מותאם אישית להערכת תוצאים קוגניטיביים משניים בתחילת המחקר, שבועות 12 ו-26.
תוצאות המחקר
המחקר מצא כי LM11A-31 בטוח ונסבל היטב, ללא חששות בטיחותיים משמעותיים. תופעות הלוואי הנפוצות ביותר כללו כאבי ראש, שלשולים, אאוזינופיליה ודלקת אף ולוע, כאשר בעיות במערכת העיכול ואאוזינופיליה היו הסיבות המובילות להפסקת הטיפול. היו יותר הפסקות טיפול בקבוצת ה-400 מ"ג בהשוואה לקבוצת ה-200 מ"ג והפלצבו. סריקת MRI לא גילתה חששות בטיחותיים, כולל חריגות הקשורות לעמילואיד. לא נמצאו הבדלים משמעותיים בציונים קוגניטיביים או חריגות בעמילואיד בין שתי קבוצות הטיפול.
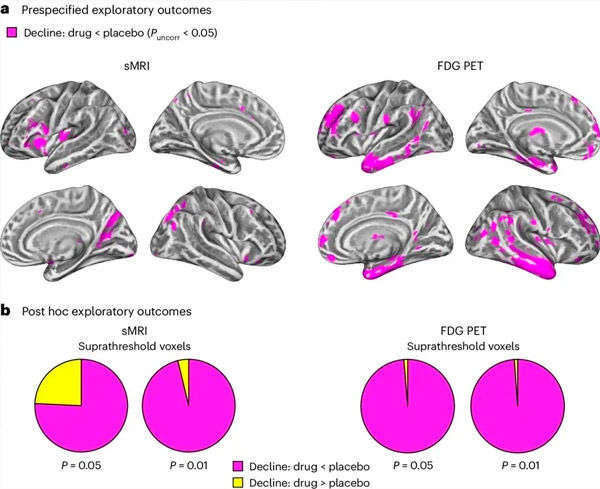
א. ניתוח דו-כיווני של מודלים מעורבים של שונות משותפת בחן אינטראקציות בין טיפול (תרופה או פלצבו) לבין זמן (לפני או אחרי טיפול). בדיקת t חד-זנבית שבחנה את השערת האינטראקציה (תרופה מאטה את התקדמות המחלה בהשוואה לפלצבו) הראתה שטיפול ב-LM11A-31 האט את הניוון האורכי (פאנלים שמאליים) ואת ההיפומטבוליזם של גלוקוז (פאנלים ימינים) בקבוצת התרופה (cMRI, n = 127; PET, n = 121) בהשוואה לקבוצת הפלצבו (cMRI, n = 66; PET, n = 62). ווקסלים המראים אינטראקציה זו מוצגים בסף לא מתוקן של P < 0.05 (מגנטה) על משטח קורטיקלי ספציפי לאוכלוסייה. ההמיספרות השמאלית והימנית מוצגות בשורות העליונות והתחתונות, בהתאמה. אזורי מוח המראים אינטראקציות שאינן עולות בקנה אחד עם ההשערה מוצגים באיור 7 בנתונים המשלימים.
ב. המספר הכולל של ווקסלים באזורי מוח פגיעים מוגדרים מראש של אלצהיימר (שטח כולל של תרשימי עוגה) המציגים אינטראקציה התואמת את ההשערה (מג'נטה) או אינטראקציה שאינה עקבית עם ההשערה (צהוב) בכל שיטת הדמיה (cMRI, פאנל שמאלי; FDG PET, פאנל ימני) בספים ליברליים יותר ויותר של P < 0.01 ו-P < 0.05 לא מתוקנים. סימולציות מונטה קרלו הראו כי יחס הווקסלים שהראו השפעות התואמות את ההשערה לעומת השפעות שאינן עקביות עם ההשערה היה גבוה משמעותית מאלה שנצפו על סמך נתונים שנוצרו באופן אקראי עבור cMRI ו-PET כאחד (P < 0.001 עבור כל שיטת הדמיה; מבחן דו-צדדי).
LM11A-31 הפחית ביעילות את העלייה ב-Aβ42 ו-Aβ40 ב-CSF בהשוואה לקבוצת הפלצבו. התרופה הראתה גם ירידה בשינוי האחוז השנתי החציוני בסמן הביולוגי של חלבון פרה-סינפטי SNAP25 וירידה בסמן הביולוגי הפוסט-סינפטי NG, דבר המצביע על האטה באובדן קשרים פרה-סינפטיים ופוסט-סינפטיים. LM11A-31 הפחית גם את העלייה ב-YKL40, מה שהוביל לירידה בציוני MMSE ולעלייה בציוני ADAS-Cog-13. התרופה גם הפחיתה את אובדן החומר האפור באונה המצחית ובקליפת המוח הקודקודית האחורית וירידה בחילוף החומרים של גלוקוז באזורים כמו קליפת המוח האנתורינלית, קליפת המוח הטמפורלית, ההיפוקמפוס, קליפת המוח האינסולרית וקליפת המוח הקדם-מצחית.
מַסְקָנָה
המחקר הגיע למסקנה כי אפנון p75NTR על ידי LM11A-31 מתאים לניסויים קליניים גדולים יותר. LM11A-31 עמד בנקודת הסיום העיקרית לבטיחות ונסבל היטב בחולים עם אלצהיימר קלה עד חמורה. התוצאות מצביעות על הצורך במחקרים נוספים עם משכי טיפול ארוכים יותר כדי להעריך את הפוטנציאל של מולקולות קטנות לווסת p75NTR כטיפול משנה מחלה במחלת אלצהיימר. המחקר הראה כי LM11A-31 השפיע באופן משמעותי על מספר סמנים ביולוגיים, כולל Aβ40, Aβ42, SNAP25, NG ו-YKL40, דבר המצביע על האטה בהתקדמות הפתולוגית. מחקרים עתידיים עשויים להעריך אינדיקטורים נוספים לבריאות גליה.
