פרסומים חדשים
מטרה נמצאה כמנטרל חלבונים רעילים במחלת פרקינסון
סקירה אחרונה: 02.07.2025

כל תוכן iLive נבדק מבחינה רפואית או נבדק למעשה כדי להבטיח דיוק עובדתי רב ככל האפשר.
יש לנו קווים מנחים קפדניים המקור רק קישור לאתרים מדיה מכובד, מוסדות מחקר אקדמי, בכל עת אפשרי, עמיתים מבחינה רפואית מחקרים. שים לב שהמספרים בסוגריים ([1], [2] וכו ') הם קישורים הניתנים ללחיצה למחקרים אלה.
אם אתה סבור שתוכן כלשהו שלנו אינו מדויק, לא עדכני או מפוקפק אחרת, בחר אותו ולחץ על Ctrl + Enter.
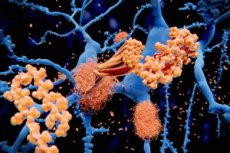
חוקרים מאוניברסיטת ברצלונה (UAB) זיהו אתר באגרגטים מוקדמים של חלבון אלפא-סינוקלאין שניתן למקד אותו כדי למנוע ממנו להפוך לסיבים עמילואידים רעילים המצטברים במוחם של אנשים עם מחלת פרקינסון.
התגלית פורסמה לאחרונה בכתב העת של האגודה האמריקאית לכימיה, במסגרת מחקר המעמיק את ההבנה של התכונות המבניות של אגרגטים ראשוניים אלה, או אוליגומרים, ופותח את הדלת לפיתוח אסטרטגיות טיפוליות חדשות להשבתתם.
המחקר נערך על ידי המדענים סלבדור ונטורה, חיימה סנטוס, ג'ורדי פוחולס ואירנצו פלהארס מהמכון לביוטכנולוגיה וביו-רפואה (IBB) ומהמחלקה לביוכימיה וביולוגיה מולקולרית.
הצטברות של אלפא-סינוקלאין היא סימן היכר של מחלת פרקינסון וסינוקלאינופתיות אחרות. זהו תהליך דינמי שבו החלבון מתאסף מעצמו ויוצר אוליגומרים שבסופו של דבר מתפתחים לסיבים עמילואידיים רעילים המצטברים במוחו של המטופל.
אוליגומרים של אלפא-סינוקלאין ממלאים תפקיד מפתח בהתפתחות ובהתקדמות המחלה ולכן מהווים מטרות טיפוליות ואבחוניות מבטיחות, במיוחד בשלבים המוקדמים של המחלה. עם זאת, אופיים החולף והדינמי מאוד מגביל את חקר המבנה שלהם ומסבך את פיתוח טיפולים שמטרתם לחסום אותם.
במחקר קודם, החוקרים מצאו כי מולקולה קטנה, הפפטיד החיידקי PSMα3, מעכבת צבירה של אלפא-סינוקלאין על ידי קשירה לאוליגומרים, חסימת פיבריליזציה ודיכוי נוירוטוקסיות. במחקר זה, הם קבעו היכן, כיצד ומתי מתרחשת קשירה זו באוליגומרים, וזיהו אזור מפתח לתהליך ההמרה המבנית הקשור לפתוגנזה של מחלת פרקינסון.
"זיהינו רצף מבני הנדרש להמרת אוליגומרים לסיבים, ובכך פתחנו תחום חדש לפיתוח מולקולות המכוונות לאוליגומרים. באמצעות תחום זה, נוכל לעצב מולקולות חדשות המחקות את התכונות של PSMα3 עם זיקה ועוצמה גדולים בהרבה", מסביר ונטורה, מנהל קבוצת המחקר לקיפול חלבונים ומחלות קונפורמציה ב-IBB ורכז המחקר.
בשילוב ניתוחים מבניים, ביופיזיקליים וביוכימיים, מצאו החוקרים כי PSMα3 פועל על ידי קשירה לקצה אחד של אלפא-סינוקלאין (קצה N), אשר מווסת את תהליך המרת האוליגומרים לסיבים. כאשר הפפטיד נקשר, הוא מכסה שני אזורים קטנים סמוכים של החלבון, P1 ו-P2, אשר הוכחו כקריטיים למעבר פתולוגי זה.
"אזור זה הוא מטרה טיפולית אידיאלית משום שהוא מזוהה על ידי פפטידים רק כאשר הם חלק מאוליגומרים, מה שמאפשר לנו לכוון את האגרגטים מבלי להשפיע על הצורה המונומרית התפקודית של אלפא-סינוקלאין, החיונית לתפקוד תקין של המוח", אומר ונטורה.
למחקר יש גם השלכות על הבנה טובה יותר של המנגנונים המולקולריים של הצורה התורשתית של מחלת פרקינסון. צורה זו, אשר תוקפת בדרך כלל אנשים בגיל צעיר יותר, קשורה לעיתים קרובות למוטציות הממוקמות באזור P2 של אלפא-סינוקלאין, כגון מוטציית G51D, הגורמת לאחת הצורות האגרסיביות ביותר של המחלה.
החוקרים הראו כי מוטציית G51D באזור הקריטי שזוהה גורמת לתנודות קונפורמציה המאטות את המרת אוליגומרים לסיבים. האטה זו מובילה להצטברות של אוליגומרים רעילים בעלי חיים ארוכים, אשר מעובדים בצורה לא יעילה על ידי צ'פרונים מולקולריים המנסים לפרק אותם.
"התגלית שלנו עשויה להוביל לפיתוח פפטידים ספציפיים שיכולים למקד את הצורות המוטנטיות הללו של אלפא-סינוקלאין, ולכן לגישה מותאמת אישית לטיפול עבור אלו הסובלים מהצורה התורשתית של מחלת פרקינסון. אנו כבר עובדים על פיתוח מולקולות אלו", אומר ונטורה.
